2. 上海海洋大学食品学院,农业农村部水产品贮藏保鲜质量安全风险评估实验室,上海 201306
龟类作为大规模水产养殖和宠物豢养的对象,其健康和医学问题正日益受到重视。上海海洋大学水族宠物医学实验室每年接诊病龟约300例,宠物龟常见的疾病有腐皮烂甲、肝病[1]、眼部感染[2-3]、肺炎[4]和外伤等[5-6],并呈逐年递增趋势。本团队在多年的临床实践中,对宠物龟常见的疾病进行深入研究;在病原学方面,有研究报道了东部锦龟(Chrysemys picta picta)中耳炎的致病菌[3];在组织病理学方面,有学者进行了钻纹龟(Malaclemys terrapin)肝病的组织病理学研究[1],建立了中华鳖(Pelodiscus sinensis)药源性肝病模型[7],从组织病理学角度分析了中华鳖脾肾性水肿病的病理变化[8];在临床药理学方面,有学者研究了广谱抗菌药物恩诺沙星在中华草龟(Chinemys reevesiis)体内的药物代谢动力学特征,制订了最佳给药方案[9],为确保用药的安全性,还深入进行了毒理学研究[10]。随着研究的深入和医疗水平的提升,在对病龟进行外科手术、胃插管、影像学检查等一系列临床诊治操作的过程中,常需要麻醉剂和麻醉师的协助。目前,丙泊酚[11]、美托咪定、氯胺酮[12-13]、阿法沙龙[14]等麻醉剂已被应用于龟鳖麻醉,但其作用期长,麻醉深度不好控制,还易引起低血压、心肌衰弱和呼吸抑制等,使用效果并不理想[15]。舒泰是一种复合麻醉剂,其商品名为“Zoletil”或“Telazol”,于20世纪60年代在美国Davis实验室研制成功,由替来他明(tiletamine)与唑拉西泮(zolazepam)按1∶1混合而成[16-17]。替来他明具有良好的止痛效果,唑拉西泮具有肌松和抗惊厥效果,这2种药物在药理学上具有互补作用[17]。舒泰安全范围较广,可肌肉注射或静脉注射且刺激性小,麻醉迅速平稳,其作用机理与氯胺酮相似,但其效力比氯胺酮强3~4倍,起效速度比氯胺酮快,持续时间大约是氯胺酮的3倍,在国外被广泛应用于动物麻醉,在国内的应用也逐渐增加[18-19]。目前,国内外尚未见将舒泰应用于龟鳖麻醉的研究。
本实验研究了不同浓度舒泰对中华草龟的麻醉效果,并利用高效液相色谱法(HPLC)测定了替来他明和唑拉西泮在中华草龟血浆中的药物代谢动力学参数,为舒泰在龟类麻醉中的应用提供参考,也为临床制定最佳给药方案提供依据。
1 材料与方法 1.1 实验材料 实验动物中华草龟俗称乌龟、泥龟、草龟等,属龟鳖目(Cheloniq)、潮龟亚科(Batagurinae)、乌龟属(Chinemys),是我国数量最多、分布最广的养殖龟种[20-21]。近年来,由于其药用价值和观赏价值逐渐被发掘,中华草龟养殖业也随之兴旺[22]。本实验用中华草龟由上海攀世动物医学科技有限公司提供,挑选体表完整、四肢健全、吃食正常、状态活跃的平均体质量为(700±18)g的中华草龟,利用控温水族箱模拟生态培养,实验期间水族箱外围黑布,水温控制在(25±1) °C。实验前2 d停食。
实验试剂舒泰购自法国维克贸易有限公司;盐酸替来他明标准品和盐酸唑拉西泮标准品购自美国USP;乙腈(色谱纯)、乙酸乙酯(色谱纯)、硼酸(分析纯)和四硼酸钠(分析纯)均购自国药集团化学试剂有限公司;磷酸氢二钠(色谱纯)、磷酸二氢钠(色谱纯)和实验用水(色谱纯)均购自上海安谱实验科技股份有限公司。
1.2 舒泰对中华草龟的麻醉效果和评价方法 舒泰对中华草龟的麻醉效果根据预实验结果,设定5个注射剂量梯度组(表1),每组3个平行,从中华草龟左后肢肌肉注射给药,分别记录麻醉诱导期、麻醉期和苏醒期的时间及麻醉过程中的行为特征和不良反应。麻醉各时期分界标准参考已有文献[14,23-24]的方法。诱导期:目光呆滞,对外界反应迟钝,屈肌反射减弱,四肢开始下垂,对外界疼痛刺激有反应。麻醉期:屈肌反射消失,自然下垂,瞳孔散大,对外界疼痛刺激反应消失,少数出现尿失禁。苏醒期:对外界疼痛刺激出现反应,恢复屈肌反射,最后逐渐恢复正常。
| 表 1 舒泰对中华草龟的分组和肌肉注射剂量 Tab.1 C. reevesiis grouping and the intramuscular injection dose of Zoletil |
麻醉效果通过比较诱导期、麻醉期、苏醒期的时长、不良反应等进行评价。评价标准用“优”、“良”和“一般”表示[24],根据麻醉目的筛选出最适麻醉剂量。其中,“优”表现为诱导期平稳,无呕吐、抽搐,达到预期麻醉深度;麻醉状态下无挣扎,诱导期短、麻醉期长、苏醒期短。“良”表现为诱导期平稳或有呕吐、抽搐或兴奋现象,达到预期麻醉深度;麻醉时间较短、苏醒期短。“一般”表现诱导期平稳或有呕吐或抽搐现象,兴奋反应大,未能达到预期麻醉深度,诱导期长、麻醉期短、苏醒期长。
1.3 唑拉西泮与替来他明在中华草龟体内药代动力学的研究方法 给药及样品采集通过比较麻醉效果,选定25 mg/kg作为注射剂量。给药后分别于0、0.10、0.42、0.50、1、2、4.75、8、12、16、24、48、72和96 h在龟颈静脉窦处采血1 mL,以3 500 r/min 离心15 min,吸取上层血浆于塑料离心管中,–40 °C保存备用。
样品前处理样品前处理方法在已有研究[13,19]的基础上进行改进。精确吸取血浆样品0.5 mL,加入0.5 mL硼酸盐缓冲液(pH 9.5);加入1 mL乙酸乙酯;加入0.5 mL 0.1 mol/L HCl溶液(每毫升含 0.1 g四硼酸钠),涡旋10 s;加入 2 mL乙酸乙酯,涡旋 20 s;静置 5 min,4 000 r/min离心8 min;吸取上清液置于10 mL试管中,向残留物中加入乙酸乙酯 2 mL,涡旋离心;吸取上清液,重复1次(共提取5次)。将5次提取液集中于10 mL试管中,提取液近8 mL,将提取液30 °C水浴,N2吹干。用1 mL V(乙腈)∶V(水溶液)=1∶3溶解,15 000 r/min离心15 min,吸取上清液经0.22 μm 滤膜过滤,进样100 μL。
色谱条件样品用岛津(SHIMADZU)SPD-20A高效液相色谱仪分析;色谱柱为SG300 PAK C18(4.6 mm×150 mm,5 μm),柱温30 °C;流动相为V(乙腈)∶V(磷酸缓冲液,pH= 6.6)=26∶74;流速为1.5 mL/min;检测波长为233 nm;进样体积为100 μL。
1.4 唑拉西泮与替来他明在中华草龟体内药物代谢动力学的标准曲线 标准曲线的制备以常规方法建立标准曲线。分别取盐酸替来他明和盐酸唑拉西泮标准品50 mg,加上述乙腈—水溶液500 mL配制成100 μg/mL标准储备液,稀释成10、5、1和0.5 μg/mL的标准液,过0.22 μm滤膜,利用HPLC进行检测,标准液处理方法同上,重复3次,以药物浓度为横坐标(x),平均峰面积为纵坐标(y)建立标准曲线。
回收率及精密度测定取空白血浆分别加入至一定体积的盐酸替来他明和盐酸唑拉西泮标准储备液中,使药物的质量浓度分别达到2.5、5.0和10.0 μg/mL,每组3个平行,利用HPLC进行检测,数据代入标准曲线,计算回收率:
回收率(%)=实际测定浓度/理论浓度值×100%
将上述样品在1 d的不同时间点上机测 3次,计算得出日内差;连续测定 3 d,计算得出日间差。以峰面积、标准差及相对标准偏差(RSD)确定日内及日间精密度,以衡量检测方法的可靠性。
1.5 数据分析实验数据用SPSS 20.0软件进行统计分析,标准曲线、药时曲线用Excel 2010绘制,药物代谢动力学模型拟合采用PK solver 2.0软件处理,并用一、二和三室模型分别以权重 1、1/C、1/C2 3 种情况拟合,根据AIC值(Akaike information criterio)来判断最适模型,并计算参数。
2 结果 2.1 舒泰对中华草龟的麻醉效果及评价肌肉注射舒泰后,中华草龟会经历诱导期(图1-b)、麻醉期(图1-c)和苏醒期(图1-d)3个阶段。结果表明,所有实验龟均无呕吐或抽搐等不良反应出现,不同注射剂量的实验组之间存在一定差异。随着注射剂量的增加,麻醉诱导期逐渐变短,麻醉期和苏醒期逐渐延长。当注射剂量为15 mg/kg时,诱导期显著高于其他实验组(P<0.05),需要较长的时间才能进入麻醉,麻醉期维持时间显著低于其他实验组(P<0.05),麻醉过程中兴奋反应剧烈,效果一般。当注射剂量为35 mg/kg时,诱导期最短,进入麻醉迅速,麻醉维持时间变化不大,但苏醒期显著长于其他实验组(P<0.05)(表2)。综合分析不同阶段的时长和临床操作实际情况,当注射剂量为25 mg/kg时,具有诱导期短、麻醉期长、苏醒迅速等特点,在临床上较适合作为中华草龟麻醉的给药剂量。

|
图 1 舒泰对中华草龟的不同麻醉阶段的症状 (a) 未注射舒泰的中华草龟;(b) 诱导期的中华草龟;(c) 麻醉期的中华草龟,(d) 苏醒期的中华草龟 Fig. 1 The symptoms of different anesthesia stages of Zoletil on C. reevesiis (a) control group; (b) C. reevesiis at induction period; (c) C. reevesiis at anesthesia period; (d) C. reevesiis at recovery period |
| 表 2 舒泰对中华草龟的麻醉效果 Tab.2 The anesthetic effect of Zoletil onC. reevesiis |
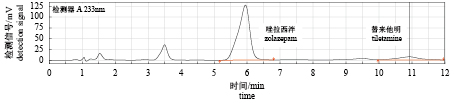
实验通过HPLC测定中华草龟体内唑拉西泮与替来他明的药物浓度。在测定条件下,基线平稳,药峰与杂峰分离良好(图2),可做实验分析依据。
|
图 2 唑拉西泮与替来他明色谱图 Fig. 2 Chromatogram of tiletamine and zolazepam |
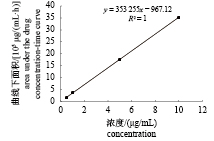
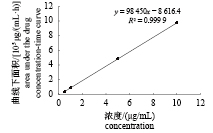
以药物质量浓度为横坐标(x, μg/mL),峰面积为纵坐标[y, μg/(mL·h)]建立标准曲线。唑拉西泮标准工作曲线(图3)方程:y=353 255x–967.12,R2=1;替来他明标准工作曲线(图4)方程:y=98 450x–8 616.4,R2=0.999 9,线性关系良好。按信噪比 S/N=3 计算最低检测质量浓度,唑拉西泮和替来他明分别为0.01和 0.02 μg/mL。
|
图 3 唑拉西泮标准工作曲线 Fig. 3 Standard curve of zolazepam |
|
图 4 替来他明标准工作曲线 Fig. 4 Standard curve of tiletamine |
实验结果显示,唑拉西泮和替来他明的回收率分别为88.03%±1.11%和91.90%±1.75%(表3),日内变异系数和日间变异系数分别为3.1%和6.0%(表4)。
| 表 3 唑拉西泮和替来他明在中华草龟血浆内的回收率 Tab.3 Recoveries of HPLC method for tiletamine and zolazepam in plasma of C. reevesiis |
| 表 4 中华草龟血浆内唑拉西泮和替来他明高效液相色谱法测定的精密度 Tab.4 Precision of HPLC method of tiletamine and zolazepam in the plasma of C. reevesiis |
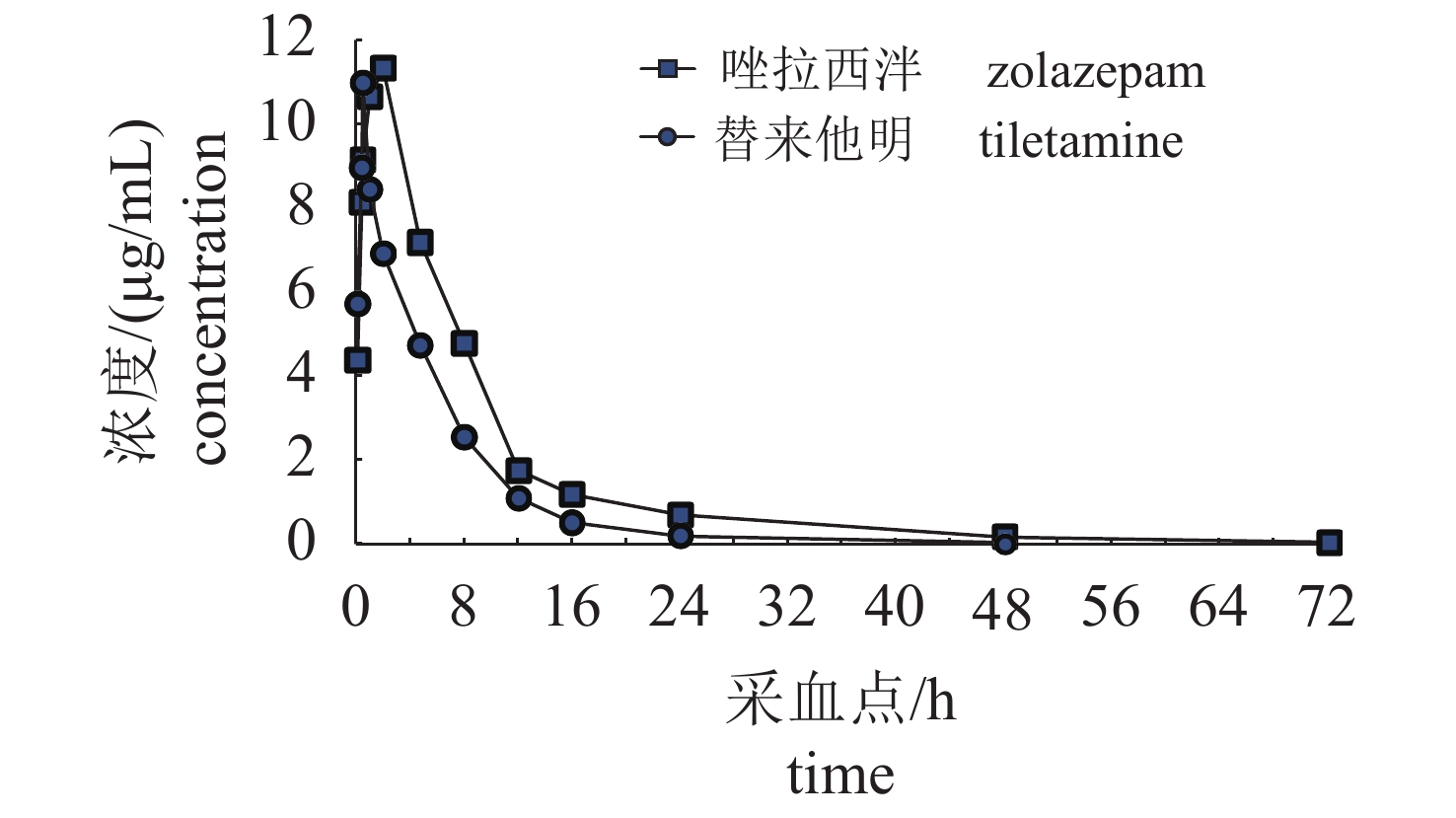
根据AIC值,唑拉西泮和替来他明在中华草龟体内的药物代谢动力学特征均适合用一次式二室开放模型来描述。唑拉西泮和替来他明的血浆药物动力学方程分别为C=13.462e–0.223t+2.127e–0.055t和C=10.619e–0.203t+0.279e–0.047t。主要药物代谢动力学参数见表5。对中华草龟肌肉注射舒泰后,不同采样时间点的血浆样品经HPLC检测到的药物浓度(表6)。根据血药浓度与时间的关系绘制唑拉西泮和替来他明的药时曲线(图5)。
| 表 5 中华草龟体内唑拉西泮和替来他明药物代谢动力学参数 Tab.5 Pharmacokinetic parameters of tiletamine and zolazepam in C.reevesiis |
| 表 6 中华草龟血浆中唑拉西泮和替来他明药物浓度 Tab.6 The concentration of tiletamine and zolazepam in the plasma of C. reevesiis (n=10) |
|
图 5 唑拉西泮和替来他明在中华草龟体内药时曲线图 Fig. 5 Concentration time curve of tiletamine and zolazepam in C. reevesiis |
舒泰作为专门针对动物的麻醉药品,在当前的动物麻醉中得到广泛应用[25-26],主要应用于家养犬、猫和大部分野生动物的保定和全身麻醉,具有高效安全的特点[27]。研究表明,利用舒泰对猎豹(Acinonyx jubatus)[24]、红毛猩猩(Pongo pygmaeus)[28]、豚鹿(Axis porcinus)[29]、南极海豹(Mirounge leonina)[30]、北极熊(Ursus maritimus)[16]等进行麻醉的过程中,诱导期平稳、迅速,未见出现呕吐或抽搐等不良反应,麻醉深度较好,这与本实验的研究结果一致,说明舒泰对动物副作用小,适合用于动物麻醉。在本实验过程中,实验龟均未因注射舒泰而出现不良反应。
舒泰与其他麻醉剂相比,苏醒期较长[17]。本实验表明,随着舒泰注射剂量的增加,麻醉期的时间变化不显著,苏醒期的时间显著变长。有研究表明,对红耳龟(Trachemys scripta)注射5 mg/kg阿尔法沙龙,可维持0.44 h的麻醉期,苏醒期为0.56 h[19]。本实验中,使用舒泰维持0.54 h的麻醉时间,苏醒期为3.14 h,明显高于注射阿尔法沙龙的苏醒期。还有研究指出,舒泰以5 mg/kg剂量注射猎豹,苏醒期在4~6 h,时间远长于注射氯胺酮所需的0.5 h[24],在关于巴马香猪(Sus barbatus)麻醉的研究中也有相似的结论[23]。这与本实验结论相似,可能是舒泰在动物体内代谢半衰期较其他麻醉剂更长的原因导致。
3.2 舒泰对中华草龟的麻醉效果理想的麻醉剂应能使麻醉对象快速进入麻醉,维持操作所需的时间,并能快速苏醒恢复正常[31-32]。大量研究表明,实验动物的最佳麻醉时间为4~6 h[25]。本实验中,注射不同剂量的舒泰,会对中华草龟产生不同程度的麻醉效果。当肌肉注射剂量为25 mg/kg时,可使中华草龟在0.42 h进入麻醉状态,并维持4.33 h,在出麻醉期后的4.14 h可恢复,较其他注射剂量组具有诱导平稳、麻醉期长等特点,能满足维持实际操作的时间要求,因此,可作为对中华草龟进行外科手术等一系列操作的指导剂量。以25 mg/kg剂量组为研究对象,通过采集进入麻醉期(0.42 h)和进入苏醒期(4.75 h)这2个时间点的血样进行检测,可以发现当唑拉西泮和替来他明的血药浓度分别达到8.12和8.96 μg/mL时,健康的中华草龟即进入麻醉期,为维持麻醉状态,唑拉西泮和替来他明的血药浓度应不低于7.18和4.73 μg/mL。
3.3 唑拉西泮和替来他明在中华草龟体内的药物代谢动力学特征经典房室模型是目前药物代谢动力学研究中最常用的基本分析方法[33]。中华草龟在肌肉注射25 mg/kg药物后,在设定的时间点进行采样检测,经药物代谢动力学软件分析可知,唑拉西泮和替来他明在中华草龟血浆中的药物代谢动力学特征均符合二室模型。有研究指出,唑拉西泮和替来他明在北极熊血浆中的药物代谢动力学特征均符合一室模型[16],唑拉西泮在猪血浆中的药物代谢动力学特征符合一室模型,替来他明的代谢符合二室模型[34]。与本实验结果不一致,可能与实验对象不同有关。
唑拉西泮和替来他明在中华草龟体内的代谢特点舒泰中2种成分在不同动物体内的代谢存在差异。Cmax 、Tmax和AUC是反映体内药物吸收速率和程度的重要的指标。猪肌肉注射10 mg/kg舒泰,血浆中唑拉西泮和替来他明的Cmax、Tmax和AUC分别为3.070 μg/mL、1.086 h、35.670 μg/(mL·h)和1.020 μg/mL、0.532 h、3.450 μg/(mL·h)[35]。还有对老虎肌肉注射5.3 mg/kg舒泰,血浆中唑拉西泮和替来他明的Cmax和Tmax分别为1.24 μg/mL、0.500 h和0.891 μg/mL、0.500 h[36]。本实验对中华草龟肌肉注射25 mg/kg舒泰,其血浆中唑拉西泮和替来他明的Cmax、Tmax和AUC分别为11.695 μg/mL、1.060 h、92.470 μg/(mL·h)和9.654 μg/mL、0.482 h、56.348 μg/(mL·h)。中华草龟的Cmax和AUC明显高于猪,Tmax小于猪,说明舒泰在中华草龟体内较猪能更好更快地被吸收。
唑拉西泮和替来他明在中华草龟体内的代谢比较舒泰中2种成分在中华草龟体内的代谢速率存在差异。本实验在中华草龟血浆中替来他明的Tmax低于唑拉西泮,表明替来他明能更快地被吸收,这与在猪上的研究结果一致[34-35]。唑拉西泮的V/F和CL/F均低于替来他明,这说明替来他明具有较高的分布容积,能更有效地从血浆中清除,舒泰在北极熊[16]、猪[35]和狗[37]的麻醉研究中也得出了相同结论。
从麻醉效果来看,按25 mg/kg的剂量注射舒泰,中华草龟在0.42 h后产生麻醉作用,唑拉西泮和替来他明的吸收半衰期T1/2Ka分别为0.261 h和0.088 h,可以推断中华草龟的麻醉作用是由舒泰的吸收所产生。从诱导期向麻醉期过渡时,唑拉西泮和替来他明的血药浓度分别为8.12 μg/mL和8.96 μg/mL;从麻醉期向苏醒期过渡时,唑拉西泮和替来他明的血药浓度分别为7.18 μg/mL和4.73 μg/mL,可以推断,中华草龟的麻醉需要较高剂量的唑拉西泮和替来他明浓度来维持。血药浓度低于麻醉有效浓度后,开始进入苏醒期,但此时血药浓度仍然较高,这可能是导致舒泰麻醉恢复期较长的原因。
| [1] |
雷洁, 王伟喆, 潘连德. 养殖菱斑龟肝病组织病理研究[J].
上海海洋大学学报, 2012, 21(6): 989-995 Lei J, Wang W Z, Pan L D. Histopathological study of hepatopathy in four diamondback Terrapins (Malaclemys terrapin) [J]. Journal of Shanghai Ocean University, 2012, 21(6): 989-995 (  0) 0)
|
| [2] |
陈晨, 潘连德. 宠物龟眼炎的病原鉴定及临床药物治疗的研究[J].
上海海洋大学学报, 2011, 20(2): 244-251 Chen C, Pan L D. Identification of pathogen from pet chelonian with ophthalmia and the clinic therapy[J]. Journal of Shanghai Ocean University, 2011, 20(2): 244-251 (  0) 0)
|
| [3] |
王伟喆, 潘连德. 东锦龟摩尔摩根氏菌的分离鉴定和药敏试验[J].
江苏农业科学, 2013, 41(10): 205-208 Wang W Z, Pan L D. Isolation, identification and drug sensitivity test of Morganella morganii of Chrysemys picta picta [J]. Jiangsu Agricultural Sciences, 2013, 41(10): 205-208 DOI: 10.3969/j.issn.1002-1302.2013.10.078 (  0) 0)
|
| [4] |
李玉平, 赵凌恭, 余春明, 等. 巴西龟肺炎、眼炎综合征的病理学观察[J].
中国兽医杂志, 2011, 47(2): 56-57 Li Y P, Zhao L G, Xu C M, et al. Pathological observation of red-eared pneumonia and ophthalmia syndrome[J]. Chinese Journal of Veterinary Medicine, 2011, 47(2): 56-57 DOI: 10.3969/j.issn.0529-6005.2011.02.030 (  0) 0)
|
| [5] |
Moon P F, Stabenau E K. Anesthetic and postanesthetic management of sea turtles[J].
Journal of the American Veterinary Medical Association, 1996, 208(5): 720-726 ( 0) 0)
|
| [6] |
Norton T M. Chelonian emergency and critical care[J].
Seminars in Avian and Exotic Pet Medicine, 2005, 14(2): 106-130 DOI: 10.1053/j.saep.2005.04.005 ( 0) 0)
|
| [7] |
陈彦伶, 牟群, 潘连德, 等. 中华鳖药源性肝病模型的构建及其病理学观察[J].
大连海洋大学学报, 2013, 28(1): 61-66 Chen Y L, Mou Q, Pan L D, et al. Establishment of drug-induced liver disease model and pathological observation in soft shell turtle Trionyx sinensis [J]. Journal of Dalian Ocean University, 2013, 28(1): 61-66 DOI: 10.3969/j.issn.2095-1388.2013.01.012 (  0) 0)
|
| [8] |
徐培培, 林启存, 潘连德. 中华鳖脾肾性水肿病病理学诊断[J].
水产学报, 2015, 39(7): 1054-1061 Xu P P, Lin Q C, Pan L D. Histopathological diagnosis on spleen-and-kidney-induced edema of Pelodiscus sinensis [J]. Journal of Fisheries of China, 2015, 39(7): 1054-1061 (  0) 0)
|
| [9] |
茅玲燕, 潘连德. 液相色谱串联质谱法研究恩诺沙星在中华草龟体内药物代谢动力学[J].
水产学报, 2019, 43(4): 1-8 Mao L Y, Pan L D. The pharmacokinetics of enrofloxacin in Chinemys reevesiis by HPLC-MS/MS [J]. Journal of Fisheries of China, 2019, 43(4): 1-8 (  0) 0)
|
| [10] |
章宇思, 潘连德, 洪滨. 连续肌注恩诺沙星对中华草龟的急性和慢性毒理研究[J].
大连海洋大学学报, 2017, 32(6): 643-650 Zhang Y S, Pan L D, Hong B. Acute and chronic toxicological effects of continuous intramuscular injection of enrofloxacin on Chinese pond turtle[J]. Journal of Dalian Ocean University, 2017, 32(6): 643-650 (  0) 0)
|
| [11] |
Bennett R A, Schumacher J, Hedjazi-Haring K, et al. Cardiopulmonary and anesthetic effects of propofol administered intraosseously to green iguanas[J].
Journal of the American Veterinary Medical Association, 1998, 212(1): 93-98 ( 0) 0)
|
| [12] |
Sleeman J M, Gaynor J. Sedative and cardiopulmonary effects of medetomidine and reversal with atipamezole in desert tortoises (Gopherus agassizii)
[J].
Journal of Zoo and Wildlife Medicine, 2000, 31(1): 28-35 DOI: 10.1638/1042-7260(2000)031[0028:SACEOM]2.0.CO;2 ( 0) 0)
|
| [13] |
Dennis P M, Heard D J. Cardiopulmonary effects of a medetomidine-ketamine combination administered intravenously in gopher tortoises[J].
Journal of the American Veterinary Medical Association, 2002, 220(10): 1516-1519 DOI: 10.2460/javma.2002.220.issue-10 ( 0) 0)
|
| [14] |
Knotek Z. Alfaxalone as an induction agent for anaesthesia in terrapins and tortoises[J].
Veterinary Record, 2014, 175(13): 327 DOI: 10.1136/vr.102486 ( 0) 0)
|
| [15] |
谢全森, 李俊伟, 杨振才. MS-222对中华鳖的麻醉效果研究[J].
山西师范大学学报(自然科学版), 2009, 23(1): 78-81 Xie Q S, Li J W, Yang Z C. Anaesthetic effects of ms-222 on Chinese soft-shelled turtles[J]. Journal of Shanxi Normal University (Natural Science Edition), 2009, 23(1): 78-81 DOI: 10.3969/j.issn.1009-4490.2009.01.019 (  0) 0)
|
| [16] |
Semple H A, Gorecki D K, Farley S D, et al. Pharmacokinetics and tissue residues of Telazol in free-ranging polar bears[J].
Journal of Wildlife Diseases, 2000, 36(4): 653-662 DOI: 10.7589/0090-3558-36.4.653 ( 0) 0)
|
| [17] |
钟亚方, 王洪斌, 范宏刚, 等. 小型猪血浆中舒泰两种成分测定方法的建立[J].
黑龙江畜牧兽医, 2008(11): 65-66 Zhong Y F, Wang H B, Fan H G, et al. A method established for determination of two kinds of components of Zoletil in miniature pig plasma[J]. Heilongjiang Animal Science and Veterinary Medicine, 2008(11): 65-66 DOI: 10.3969/j.issn.1004-7034.2008.11.035 (  0) 0)
|
| [18] |
Akkerdaas L C. Recent developments in domestic animal anesthesia[J].
Tijdschrift Voor Diergeneeskunde, 2008, 133(24): 1048-1054 ( 0) 0)
|
| [19] |
Madbouly K, Alshahrani S, Al-Omair T, et al. Efficacy of local subcutaneous anesthesia versus intramuscular opioid sedation in extracorporeal shockwave lithotripsy: a randomized study[J].
Journal of Endourology, 2011, 25(5): 845-849 DOI: 10.1089/end.2010.0427 ( 0) 0)
|
| [20] |
周赞, 蔡梦思, 刘虞, 等. 红耳滑龟和中华草龟幼体体温与运动的热依赖性、补偿生长及免疫力[J].
生态学报, 2016, 36(21): 7014-7022 Zhou Z, Cai M S, Liu Y, et al. Body temperature, thermal dependence of locomotor performance, compensatory growth, and the immunity of hatchling red-eared turtles and Chinese pond turtles[J]. Acta Ecologica Sinica, 2016, 36(21): 7014-7022 (  0) 0)
|
| [21] |
贺刚, 何力, 方春林, 等. 中华草龟(♀)与中华花龟(♂)及其杂种F1代染色体及同工酶比较
[J].
淡水渔业, 2012, 42(2): 3-9 He G, He L, Fang C L, et al. The karyotype and lsozymes of hybrid turtle (Chinemys reevesii♀×Ocadia sinensis♂) and comparison with their parents [J]. Freshwater Fisheries, 2012, 42(2): 3-9 DOI: 10.3969/j.issn.1000-6907.2012.02.001 (  0) 0)
|
| [22] |
黄春红, 罗玉双, 韩庆, 等. 人工养殖中华草龟的营养成分与食用价值[J].
江苏农业科学, 2017, 45(6): 157-161 Huang C H, Luo Y S, Han Q, et al. Nutritional ingredients and edible value of artificial cultured Chinese turtle[J]. Jiangsu Agricultural Sciences, 2017, 45(6): 157-161 (  0) 0)
|
| [23] |
Zhang B. Anaesthetic effects of ketamine combined anesthetic and the pharmacokinetics study in miniature pigs[D]. Harbin: Northeast Agricultural University, 2011(in Chinese).
( 0) 0)
|
| [24] |
徐春忠, 吴锋, 文德亮, 等. 舒泰与氯胺酮对猎豹麻醉效果的比较[J].
畜牧与兽医, 2010, 42(5): 88-91 Xu C Z, Wu F, Wen D L, et al. Comparison of anesthetic effects of Zoletil and ketamine on Acinonyx jubatus [J]. Animal Husbandry & Veterinary Medicine, 2010, 42(5): 88-91 (  0) 0)
|
| [25] |
覃筱燕, 杨林, 张淑萍, 等. 常用麻醉药物麻醉效果的比较[J].
中央民族大学学报(自然科学版), 2005, 14(3): 264-268 Qin X Y, Yang L, Zhang S P, et al. Comparison between the effects of different anaesthetic in common use[J]. Journal of the Central University For Nationalities (Natural Sciences Edition), 2005, 14(3): 264-268 DOI: 10.3969/j.issn.1005-8036.2005.03.014 (  0) 0)
|
| [26] |
郭优勤, 郭锐, 魏桂林, 等. 浅谈舒泰麻醉药在动物临床麻醉中的应用[J].
中国现代药物应用, 2012, 6(1): 77-78 Guo Y Q, Guo R, Wei G L, et al. Application of Zoletil in animal clinical anesthesia[J]. Chinese Journal of Modern Drug Application, 2012, 6(1): 77-78 DOI: 10.3969/j.issn.1673-9523.2012.01.063 (  0) 0)
|
| [27] |
魏巍. 犬使用舒泰期间体温降低程度的研究[J].
吉林畜牧兽医, 2010, 31(6): 13-14, 18 Wei W. Research of hypothermia during using Zoletil towards dogs[J]. Jilin Animal Husbandry and Veterinary Medicine, 2010, 31(6): 13-14, 18 DOI: 10.3969/j.issn.1672-2078.2010.06.006 (  0) 0)
|
| [28] |
孙景, 黄海军, 刘建勋. 舒泰对红猩猩麻醉效果的初步观察[J].
畜牧与兽医, 2016, 48(6): 157-158 Sun J, Huang H J, Liu J X. Preliminary observation of anesthetic effect of Zoletil on orangutans[J]. Animal Husbandry & Veterinary Medicine, 2016, 48(6): 157-158 (  0) 0)
|
| [29] |
陈维刚, 牛李丽, 邓家波, 等. 舒泰麻醉剂对豚鹿的麻醉效果观察[J].
动物医学进展, 2014, 35(2): 127-129 Chen W G, Niu L L, Deng J B, et al. Anaesthesia effects of Zoletil on hog deer[J]. Progress in Veterinary Medicine, 2014, 35(2): 127-129 DOI: 10.3969/j.issn.1007-5038.2014.02.029 (  0) 0)
|
| [30] |
Bornemann H, De Bruyn P J N, Reisinger R R, et al. Tiletamine/zolazepam immobilization of adult post-moult southern elephant seal males[J].
Polar Biology, 2013, 36(11): 1687-1692 DOI: 10.1007/s00300-013-1378-5 ( 0) 0)
|
| [31] |
Gilderhus P A, Marking L L. Comparative efficacy of 16 anesthetic chemicals on rainbow trout[J].
North American Journal of Fisheries Management, 1987, 7(2): 288-292 DOI: 10.1577/1548-8659(1987)7<288:CEOACO>2.0.CO;2 ( 0) 0)
|
| [32] |
Marking L L, Meyer F P. Are better anesthetics needed in fisheries?[J].
Fisheries, 1985, 10(6): 2-5 DOI: 10.1577/1548-8446(1985)010<0002:ABANIF>2.0.CO;2 ( 0) 0)
|
| [33] |
周鲁, 蒋学华. 药动学模型的辨识问题研究[J].
中国药房, 2005, 16(7): 525-527 Zhou L, Jiang X H. Study on identification problems of the pharmacokinetic models[J]. China Pharmacy, 2005, 16(7): 525-527 DOI: 10.3969/j.issn.1001-0408.2005.07.017 (  0) 0)
|
| [34] |
Kumar A, Mann H J, Remmel R P, et al. Pharmacokinetic study in pigs and in vitro metabolic characterization in pig- and human-liver microsomes reveal marked differences in disposition and metabolism of tiletamine and zolazepam (Telazol)[J].
Xenobiotica, 2014, 44(4): 379-390 DOI: 10.3109/00498254.2013.833362 ( 0) 0)
|
| [35] |
Kumar A, Mann H J, Remmel R P. Pharmacokinetics of tiletamine and zolazepam (Telazol) in anesthetized pigs[J].
Journal of Veterinary Pharmacology and Therapeutics, 2006, 29(6): 587-589 DOI: 10.1111/jvp.2006.29.issue-6 ( 0) 0)
|
| [36] |
Lewis J C M, Teale P, Webber G, et al. Comparison of tiletamine and zolazepam pharmacokinetics in tigers (Panthera tigris) and leopards (Panthera pardus): do species differences account for adverse effects in tigers?
[J].
The Veterinary Journal, 2014, 201(3): 302-306 DOI: 10.1016/j.tvjl.2014.05.041 ( 0) 0)
|
| [37] |
Noh K, Kim K S, Ahn B, et al. Simultaneous determination of zolazepam and tiletamine in dog plasma by liquid chromatography coupled to a tandem mass spectrometry[J].
Biomedical Chromatography, 2012, 26(10): 1133-1136 DOI: 10.1002/bmc.v26.10 ( 0) 0)
|
2. College of Food Sciences and Technology, Quality and Safety Risk Assessment Laboratory of Aquatic Products Storage, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China
 2019, Vol. 43
2019, Vol. 43


