哺乳动物的性别决定是一个十分复杂的过程,在胚胎发育过程中需要启动一系列转录因子和生长因子的表达,从而完成这一过程。在XY性腺中,性别决定关键时期SRY/Sry在支持细胞中的瞬时表达可以诱导下游一系列雄性特异基因(Sox9、Fgf9和Dmrt1等)在未分化的双向潜能性腺中表达,从而激活雄性分化通路,性腺发育为精巢[1-2]。在XX性腺中,Foxl2、Rspondin-1(Rspo1)/Wnt4/β-catenin等雌性特异转录因子和信号通路启动雌性性别决定通路,性腺发育为卵巢[3-4]。Rspo1/Wnt4/β-catenin所介导的生殖细胞信号通路和Foxl2等介导的体细胞信号通路与Sry诱导的雄性Fgf9、Sox9信号通路相互拮抗,进而决定哺乳动物未分化性腺的最终命运[5-7]。在人类,RSPO1基因的突变导致XX病人完全性逆转,因此,RSPO1被认为是卵巢发育的激活基因[8]。
在小鼠(Mus musculus)、鸡(Gallus gallus)、红耳龟(Trachemys scripta elegans)这3种具有不同性别决定机制的物种雌性性别决定与分化的关键时期,Rspo1的表达都显著上调,暗示在进化过程中Rspo1信号通路在卵巢发育中的作用十分保守[9]。功能研究表明,在XX小鼠中,Rspo1突变导致生殖细胞增殖与减数分裂等过程受阻;同时,性腺出现多种雄性化特征,并伴随血清雄激素升高,但是并没有发生完全的性逆转。在XY小鼠中,同时敲除Rspo1和Sox9,性腺仍发育为精巢,暗示Rspo1对卵巢发育十分重要[10-14]。Rspo家族成员包含N端信号肽、2个富含半胱氨酸的弗林结构域(FU)和1个血小板反应素1型结构域(TSP1)以及C端的基础氨基酸富含区,Rspo1蛋白主要是通过2个FU结构域激活Wnt/β-catenin信号通路从而发挥作用[15-16],但是TSP1结构域的缺失同样会影响激活Wnt信号通路的效果[16]。
一直以来,鱼类性别的研究对于水产领域有着较大的科研和经济价值。在哺乳动物中,未分化性腺的发育方向主要由胚胎的染色体类型决定,而鱼类由于进化地位特殊以及物种的多样性,其性腺发育也表现出多样性。早期的表达数据暗示,Rspo1/Wnt/β-catenin信号通路在黑鲷(Sparus macrocephlus)、青鳉(Oryzias latipes)、斑马鱼(Danio rerio)、虹鳟(Oncorhynchus mykiss)的卵巢发育中具有重要作用[17-20]。在青鳉中,雌激素处理导致Rspo1在XY性腺中表达上调[20];反之,在XY青鳉中,过表达Rspo1导致其性腺向卵巢方向发育[21]。此外,在对尼罗罗非鱼(Oreochromis niloticus)的研究中也发现,Rspo1敲除导致XX个体性腺减数分裂延迟,发育停滞,雄激素水平升高,即Rspo1对卵巢的分化与维持必不可少[22]。
在脊椎动物中,雌核发育是一种单性生殖方式,通过这种生殖方式可以产生具有相似遗传背景的全雌后代。在两性生殖的硬骨鱼类中,Rspo1可以影响雄性基因的表达和雄激素的合成,从而对卵巢分化与维持产生影响。然而,Rspo1在单性生殖的硬骨鱼类中是否具有相似的表达模式,并行使类似的功能目前还未见报道。淇河鲫(Carassius auratus),鲤形目(Cypriniformes),鲤科(Cyprinidae),鲫属(Carassius),是银鲫在长期生态适应过程中形成的地方性变异种群,既可以进行雌核发育也可以进行两性生殖,是河南省特有名贵优质鱼类。相关研究表明,在繁殖季节用异源精子刺激淇河鲫卵子,受精卵将通过雌核发育成为全雌个体[23],但相关的分子机制尚不明确,为了探索Rspo1/β-catenin信号通路在淇河鲫性别决定与分化中的作用,实验克隆了Rspo1 cDNA,检测该基因时空表达规律,以及芳香化酶抑制剂Letrozole处理及高温诱导性逆转产生的雄鱼精巢中的表达情况,为更深入了解该基因在雌核发育(单性生殖)鱼类性别决定与分化中的作用提供一定的基础。
1 材料与方法 1.1 实验材料雌性亲本淇河鲫取自河南师范大学水产养殖基地,在繁殖季节将淇河鲫与雄性黄河鲤(Cyprinus carpio)(取自河南师范大学水产养殖基地)亲鱼按8∶1的比例放入亲鱼池,人工注射催产素,随后放入养殖系统进行流水刺激,效应时间结束后收集淇河鲫卵子,并挤入黄河鲤精液刺激,用羽毛搅拌后布于网片上,在静水中进行孵化。孵化过程中取各时期胚胎和不同时期性腺材料,每个时期各取3个平行样品,置于液氮保存。按TaKaRa RNAiso Plus (TaKaRa,大连)试剂盒说明书提取总RNA。使用ND-2000核酸蛋白仪测定RNA浓度与OD值,选取A260/A280为1.8~2.0,且琼脂糖凝胶电泳完整的RNA样品用于后续实验。
1.2 淇河鲫Rspo1基因cDNA的克隆根据GenBank上已报道的其他硬骨鱼类Rspo1保守序列设计淇河鲫Rspo1正、反向PCR引物(表1),以淇河鲫成鱼卵巢总RNA为模板,按照Prime Script II 1st Strand cDNA Synthesis Kit (含gDNA Eraser)(TaKaRa,大连)说明书合成第一链cDNA。以第一链cDNA为模板进行PCR扩增:94 °C预变性3 min; 94 °C, 30 s,59 °C 30 s, 72 °C 1 min 30 s,共35个循环;72 °C延伸10 min。PCR扩增产物经1.5%琼脂糖凝胶电泳检测,纯化、连接、转化,将阳性菌落送北京英俊公司进行测序。在已获得核心序列的基础上设计3′-RACE和5′-RACE的特异性引物(表1),进行3′和5′末端扩增。
| 表 1 本研究中所用引物序列 Tab.1 The sequences of primers used in present study |
将测序所得Rspo1基因cDNA序列用DNAstar软件进行拼接,利用NCBI进行Blastn同源性比对(http://blast.ncbi.nlm.nih.gov/),ExPASy程序(http://www.expasy.ch/tools/)推算其开放阅读框和编码氨基酸序列情况,用SMART(http://smart.emblheidelberg.de/)进行信号序列和蛋白结构域分析。利用MEGA 6.0软件邻位相连法Neighbor-Joining (Bootstrap values为1 000),以人的RSPO3为外类群构建系统进化树。
1.4 淇河鲫Rspo1组织分布为探索Rspo1基因在淇河鲫不同组织中的表达模式,取健康雌性成鱼(个体大小均一,约500 g)肠、肝脏、脾脏、卵巢、肾脏、肌肉、心脏、脑等组织,按照“实验材料”中的方法提取RNA,以总RNA为模板,按照Prime Script RT reagent Kit with gDNA Eraser (TaKaRa,大连)操作说明进行逆转录合成cDNA,将cDNA稀释10倍作为定量PCR模板。利用克隆得到的Rspo1基因开放读码框序列设计相应PCR引物,并以包含相应基因的质粒10倍梯度稀释来检测引物扩增效率。所有的定量PCR反应体系如下,反应体系(20 μL):2×SYBR Premix Ex Taq (TaKaRa, 大连)10 μL,上、下游引物各0.5 μL,cDNA模板2 μL,ddH2O 7 μL;反应程序采用两步法:94 °C预变性30 s;94 °C 5 s,60 °C 20 s,40个循环。为了保证定量PCR的可靠性,每个组织分别取自3条鱼,即3个平行样品,以β-actin为内参,依据2-ΔΔCt法计算Rspo1相对表达量,以mean±SD表示。使用SPSS软件进行方差分析和多重比较,显著性水平设为P<0.05。
1.5 淇河鲫Rspo1基因在不同发育时期的表达模式取不同发育时期(未受精卵子、受精卵、囊胚期、原肠胚期、神经胚期、尾芽期、心跳期、出膜期)全胚和性别决定与分化关键时期[10、20、30、40、60 dah (孵化后天数,days after hatching)]性腺材料(10、20、30 dah为去除脑、卵黄和内脏及肌肉的躯体材料),不同时期各取3个平行样品,提取RNA,并逆转录为cDNA,检测Rspo1表达量。具体方法参照“实验材料”和“淇河鲫Rspo1组织分布”。
1.6 Letrozole处理对Rspo1在性腺中表达的影响按Letrozole 200 mg/kg的量将药物溶于无水乙醇后混入相应重量的饵料,混匀,37℃烘干备用。用Letrozole处理饵料投喂孵化后5 d的淇河鲫(200尾),持续投喂60 d,然后正常饲养至210 dah,同时用只混有酒精的正常饲料饲养的淇河鲫作为对照组。分别取对照组和处理组淇河鲫性腺,波恩试液固定,石蜡包埋,切片,H.E染色,观察处理组淇河鲫性腺表型。使用定量PCR检测Rspo1在处理组和对照组性腺中的表达差异。RNA提取、逆转录、定量PCR参照“实验材料”和“淇河鲫Rspo1组织分布”。
1.7 不同养殖温度对淇河鲫性腺中Rspo1表达的影响研究表明鲫的性别分化受养殖温度影响,将10 dah的淇河鲫分成2组,对照组室温养殖(21 °C),处理组33 °C养殖,60 d后将2组实验鱼同时转移至室外水泥池分别常温养殖[(21±2)°C]。在120 dah时取性腺组织,一半用于波恩试液固定,组织切片观察性腺表型;另一半提RNA,检测性腺中Rspo1表达变化。RNA提取、逆转录、定量PCR方法同“实验材料”和“淇河鲫Rspo1组织分布”。
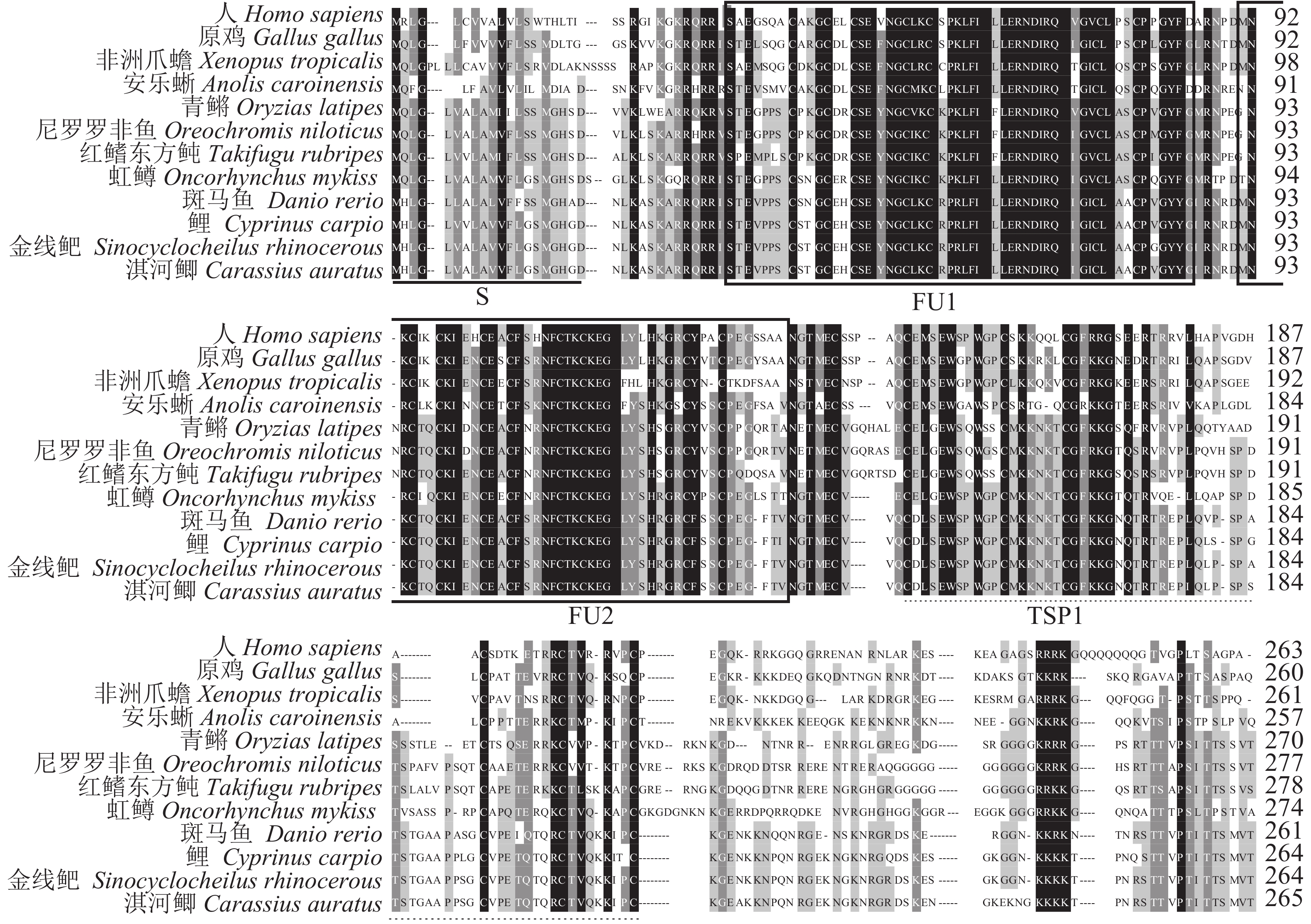
2 结果 2.1 淇河鲫Rspo1 cDNA和氨基酸序列分析将扩增所得PCR产物经亚克隆测序、拼接,获得淇河鲫Rspo1基因cDNA序列,长1 243 bp (MH243761)。包括5′非编码区318 bp,3′非编码区127 bp,开放读码框798 bp,共编码265个氨基酸残基(图1),预测相对分子质量29.32 ku,蛋白等电点9.5。序列分析发现,淇河鲫Rspo1同其他物种Rspo1一样,具有2个典型FU保守结构域(24~86、92~136)和1个TSP1结构域(148~211),N端信号肽和C端低复杂区(图2,图3)。

|
图 1 淇河鲫Rspo1基因cDNA与氨基酸序列 小写字母表示5′和3′非编码区,大写字母表示编码区,下划线表示起始密码子,*表示终止密码子 Fig. 1 Sequence of cDNA and deduced amino acid sequences of Rspo1 in C. auratus The lowercase indicate 5′ and 3′ UTR, and the ORF is presented in capital letters, initiation codon is underlined and the termination codon is indicated by an asterisk |

|
图 2 Rspo1蛋白保守结构域 S. 前导信号肽;FU1、FU2. 富含半胱氨酸的furin-like结构域;TSP1. 血小板反应蛋白结构域;low complexity. 低复杂区 Fig. 2 Conserved domain structure ofC. auratus Rspo1 S. a leading signal peptide; FU1, FU2. cysteine-rich furin-like domains; TSP1. a thrombospondin-type 1 domain |
|
图 3 淇河鲫Rspo1与其他物种Rspo1氨基酸序列比对 使用ClustalX进行多序列比对,下划线表示信号肽(S),黑框分别表示FU1和FU2结构域,黑色虚线表示TSP1结构域 Fig. 3 Alignment of Rspo1 in C. auratus with those of other vertebrates The program ClustalX is used to align the Rspo1 sequences; the N-terminus signal is indicated by a solid horizontal line(S); two furin-like type Cys-rich domains (FU1, FU2) are boxed; the thrombospondin-type 1 domain (TSP1) is indicated by dotted line |
氨基酸序列比对结果显示,淇河鲫Rspo1与金线鲃(Sinocyclocheilus rhinocerous)相似性高达97%;与鲤、斑马鱼等鲤科鱼类相似性为89%~92%;与尼罗罗非鱼、青鳉等非鲤科鱼类相似性为61%~68%;与哺乳类、爬行类等高等脊椎动物的相似性为51%~57%(表2)。利用MEGA 6.0构建系统进化树,进化树分为2支,硬骨鱼类聚为一支,哺乳类、鸟类、爬行类和两栖类聚为一支。淇河鲫Rspo1位于鱼类的一支,并且与鲤科鱼类聚为一小支,与青鳉、尼罗罗非鱼等非鲤科鱼类聚为一大支,这与淇河鲫的分类地位相一致(图4)。
| 表 2 淇河鲫与其他物种Rspo1氨基酸序列的同源性 Tab.2 GenBank accession numbers andthe identity of Rspo1 |

|
图 4 Rspo1系统进化树 Fig. 4 Phylogenetic tree of Rspo1 from vertebrates |
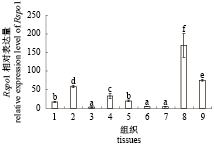
定量PCR结果显示Rspo1在成体淇河鲫不同组织中呈现泛表达模式,在肌肉中相对表达量最高,在卵巢、鳃、肝脏等组织中次之,在其他组织中表达量较低(P<0.05)(图5)。
|
图 5 Rspo1组织分布 不同的字母表示差异显著(P<0.05),下同。1.脑;2.鳃;3.心脏;4.肠;5.肝脏;6. 脾脏;7.肾脏;8.肌肉;9.卵巢 Fig. 5 Tissue distribution of C. auratus Rspo1 byReal-time PCR Different lowercase indicates significant difference (P<0.05), the same below. 1. brain; 2. gill; 3. heart; 4. intestines; 5. liver; 6. spleen; 7. kidney; 8. muscle; 9. ovary |
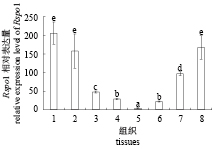
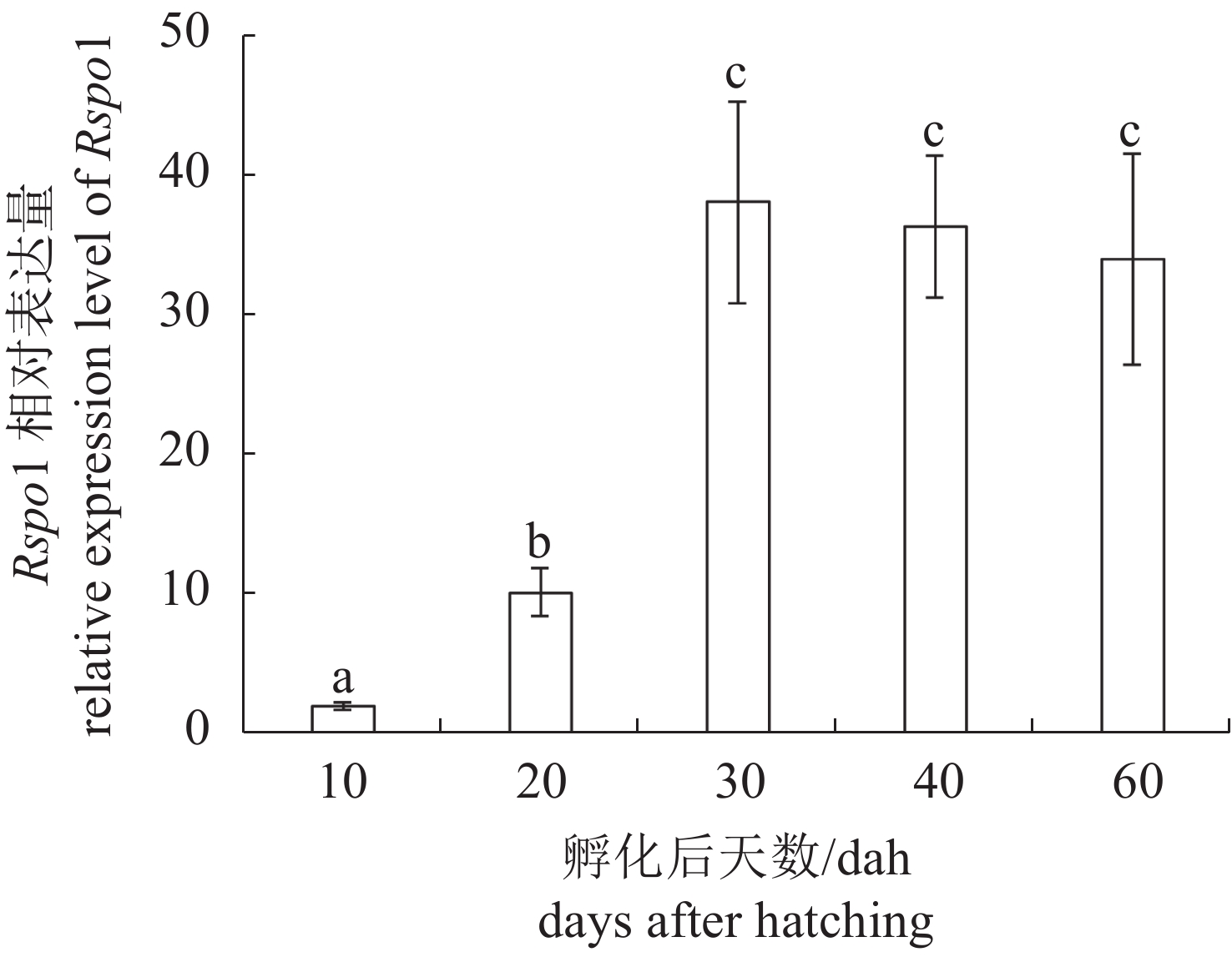
定量PCR结果显示,在胚胎发育过程中,Rspo1相对表达量从受精卵期到神经胚期持续降低,尾芽期至出膜期逐步升高。该基因在未受精的卵子和受精卵中表达量没有显著差别,推测Rspo1很可能是一个母源因子(P<0.05)(图6)。个体发生结果显示,Rspo1在性腺中表达量从20 dah (20~30 dah为鲫性别决定与分化关键时期)开始逐渐升高,随后一直维持在较高水平(P<0.05)(图7)。
|
图 6 Rspo1基因在淇河鲫胚胎期的相对表达量 1. 未受精卵;2. 受精卵;3. 囊胚期;4. 原肠胚期;5. 神经胚期;6. 尾芽期;7. 心跳期;8. 出膜期 Fig. 6 Expression of Rspo1in different embryonic development stages of C. auratus 1. unfertilized eggs; 2. fertilized egg; 3. blastula stage; 4. gastrula stage; 5. neurula stage; 6. tail-bud; 7. heart-beating; 8. hatching stage |
|
图 7 Rspo1基因在淇河鲫性别决定与分化关键时期的相对表达量 Fig. 7 Expression of Rspo1 during the critical period of sex determination/differentiation in theC. auratus gonads assayed by real-time PCR |
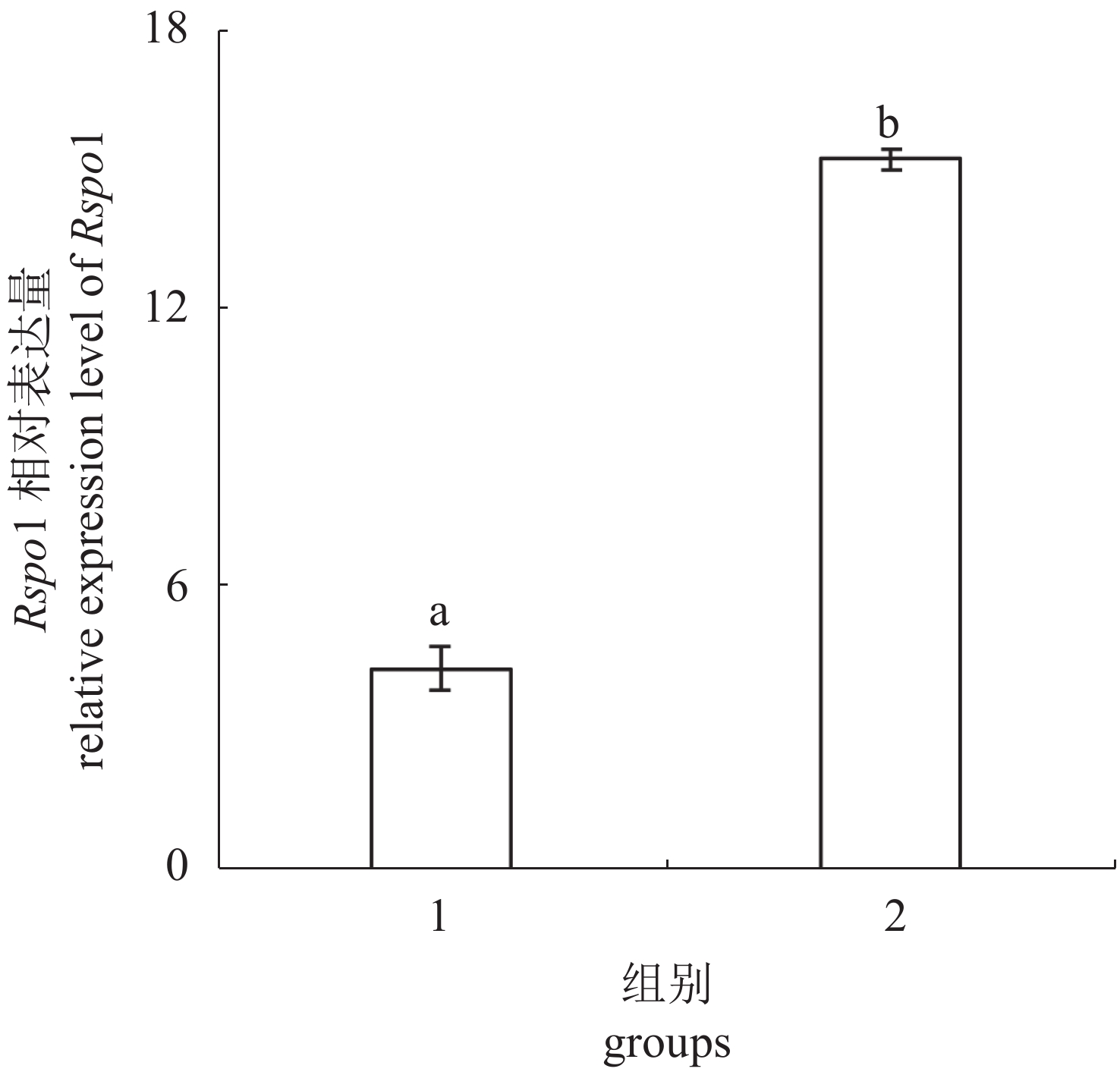
淇河鲫作为天然雌核发育三倍体,异源精子刺激,自然条件下发育为全雌个体,实验利用Letrozole处理性腺未分化淇河鲫60 d,然后投喂正常饵料饲养至210 dah,组织学结果显示,对照组性腺中充满各时相卵母细胞,Letrozole处理组性腺中可以观察到各时期精细胞,即原本将发育为卵巢的淇河鲫性腺发育为精巢(性逆转率98%)。定量PCR结果显示,与对照组相比,Rspo1在处理组性腺(精巢)中的表达量显著高于对照组(卵巢)(P<0.05)(图8)。
|
图 8 定量PCR检测Letrozole处理后Rspo1在性腺中的表达变化 1. 对照组;2. Letrozole处理组 Fig. 8 Expression of Rspo1 in gonads of the control and Letrozole-treated female C. auratus 1. control group;2. Letrozole treatment group |
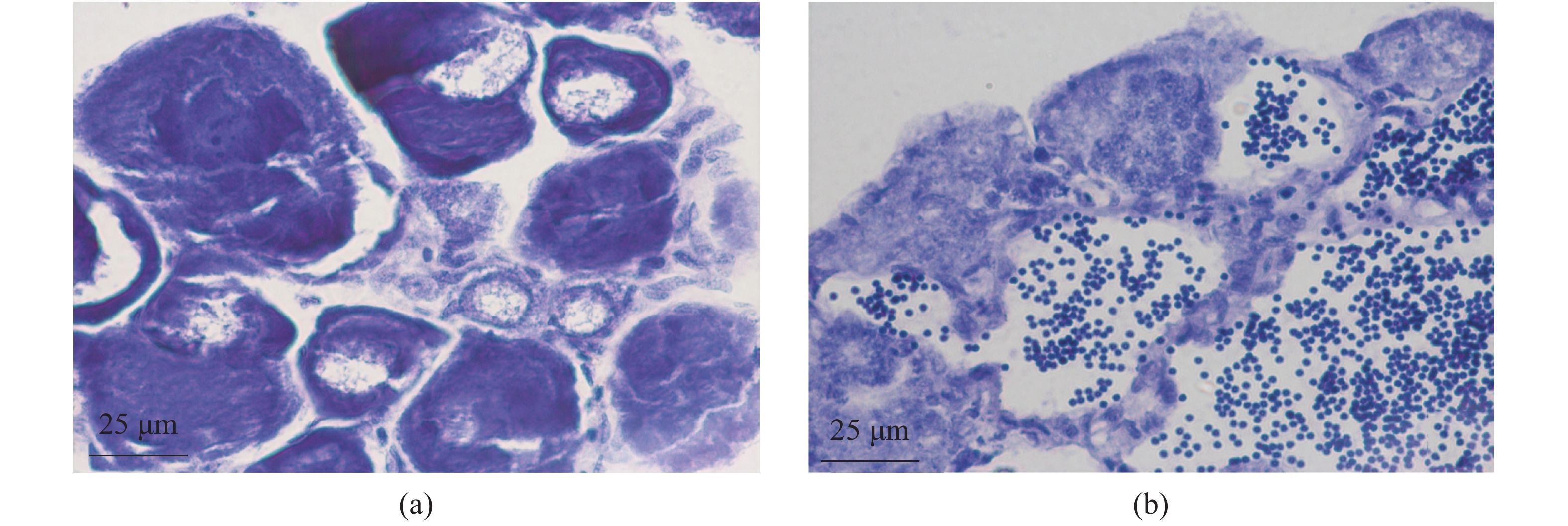
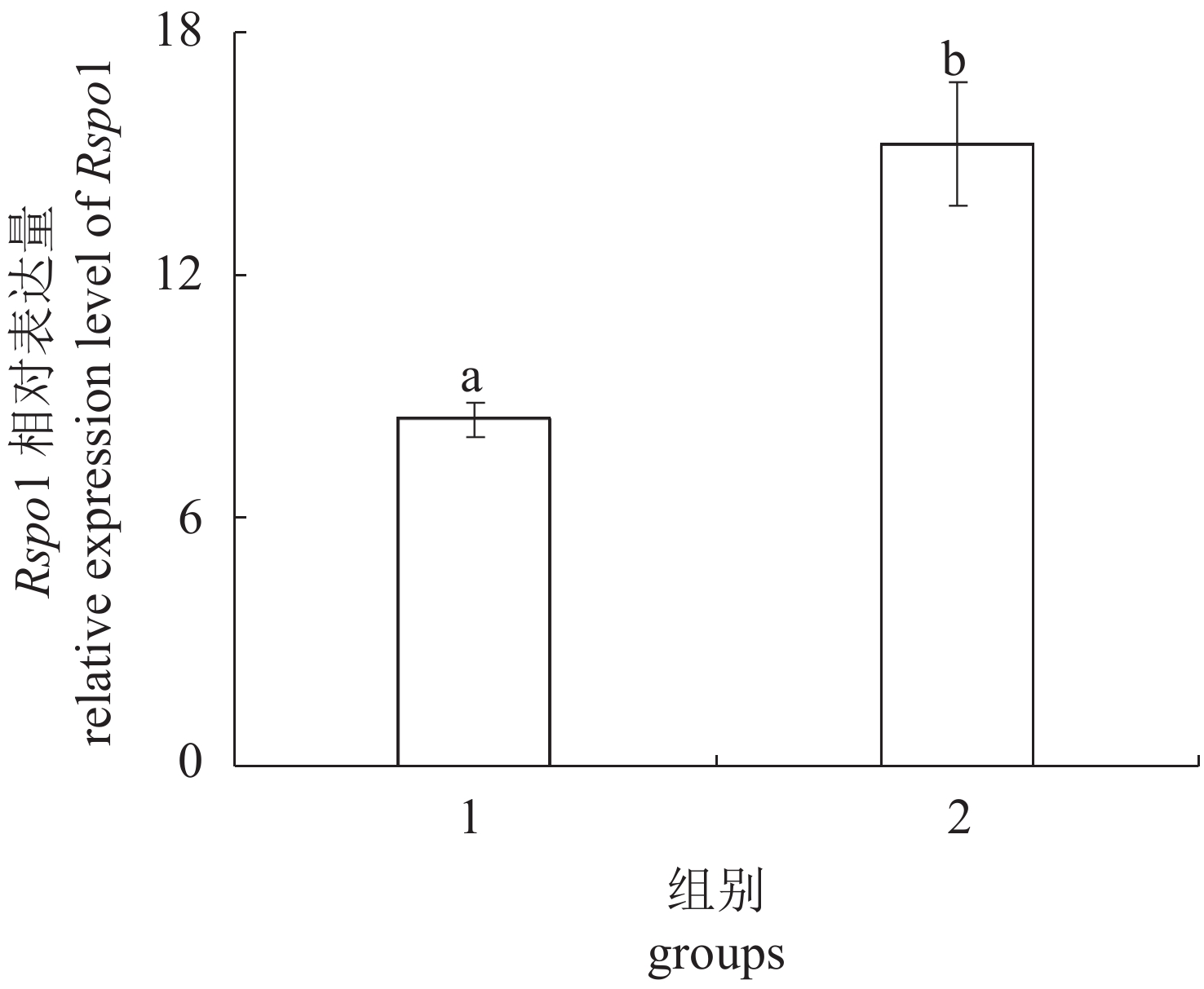
将10 dah淇河鲫于室温和33 °C下分别养殖60 d,然后转移至室外水泥池正常饲养至120 dah,取性腺材料进行组织学观察,结果显示,33 °C可以诱导原本要发育为卵巢的淇河鲫性腺发育为精巢(雄性率100%)(图9)。定量PCR结果显示,与对照组相比,Rspo1在处理组性腺(精巢)中的表达量显著高于对照组(卵巢)(P<0.05)(图10)。
|
图 9 33 °C养殖对雌性个体性腺分化发育的影响 (a)室温(21 °C)养殖组淇河鲫性腺发育为卵巢,性腺中充满不同时相的卵母细胞;(b)33 °C养殖组淇河鲫性腺发育为精巢,性腺中无卵母细胞,可见不同时期精母细胞 Fig. 9 Morphological observation of gonad in fish reared at 33 °C for 2 months (a)the fish reared at room temperature (21 ℃) was female, with the ovary filled with oocytes at different phases; (b)fish reared at 33 °C for 2 months,the gonad developed into testis, and there is no oocytes, the gonads are filled with spermatocytes |
|
图 10 定量PCR检测不同养殖温度对性腺中Rspo1表达的影响 1. 对照组;2. 33 °C组 Fig. 10 Expression profile of Rspo1 in the gonad at different rearing temperature by Real-time PCR 1. control group; 2. 33 °C group |
本研究克隆得到淇河鲫Rspo1基因cDNA,并对其时空表达模式进行探索。淇河鲫Rspo1基因与斑马鱼类似,系母源因子,在性分化关键时期上调,同时表现出两性表达差异,暗示Rspo1可能在淇河鲫卵巢分化与维持中起到一定作用。
Rspo1作为一种分泌蛋白,具有N端信号肽,2个FU结构域,1个TSP1结构域,1个碱性氨基酸富含区(BR),以及富含正电荷氨基酸的C端[24-25]。研究表明,Rspo1主要通过2个FU结构域激活Wnt/β-catenin信号通路,从而在人、小鼠、羊等哺乳动物性别决定与分化中发挥重要作用,否定了长久以来人们认为雌性性别决定是被动发育过程这一观点[15-16,26],但是TSP1和BR结构域的缺失同样影响激活Wnt信号通路的效果[16]。本研究中克隆到淇河鲫Rspo1同样具有以上结构域,同时淇河鲫Rspo1与四足动物以及其他硬骨鱼类具有较高的相似性,暗示本研究中克隆得到的序列是淇河鲫Rspo1基因,在进化过程中,Rspo1可能在卵巢发育过程中具保守功能。
与斑马鱼、青鳉研究结果一致,淇河鲫Rspo1基因在各个组织都有表达,在肌肉组织中的表达量最高,卵巢、鳃、肝脏次之,作为一个泛表达因子,它在参与性别分化的同时,Rspo1还可能与肌肉生长、免疫等有关。淇河鲫Rspo1基因在未受精的卵子与受精卵中表达没有显著差异,并且在发育早期先降低,后升高,暗示Rspo1可能是一个母源性因子,这与斑马鱼研究结果一致,所以淇河鲫Rspo1作为一个母源因子可能参与了早期胚胎发育。
在山羊、小鼠、鸡、红耳龟早期性别决定与分化的起始阶段,Rspo1表达呈现出两性差异[6,9]。在小鼠卵巢发育过程中Rspo1表达的不断上调,进一步暗示它在卵巢发育过程中具有重要作用[27]。同样,在青鳉、尼罗罗非鱼卵巢早期发育过程中Rspo1表达在雌性个体中也逐步上调[20,22]。经异源精子刺激产生全雌淇河鲫个体,在发育过程中Rspo1在性腺中表达量从20 dah (淇河鲫性别决定与分化关键时期)开始上调,暗示该基因在淇河鲫卵巢决定与分化过程中很可能具有重要作用,在进化过程中该基因在雌性动物卵巢分化中可能具有保守功能。
越来越多的研究表明,在硬骨鱼类的性别分化关键时期,温度的变化可以影响雌雄性别比例,即温度可以影响鱼类性别分化发育的方向[28-34]。最新研究表明,银鲫性别决定与分化也受温度影响,高温条件可以使雌核发育的银鲫雄性比例升高,当养殖温度超过31 °C时,原本要发育为全雌个体的银鲫却全发育为雄性群体[35]。本研究发现高温(33 °C)养殖使淇河鲫发育为全雄个体。在山羊、小鼠、鸡、红耳龟、斑马鱼、青鳉、尼罗罗非鱼等动物性别分化过程中,Rspo1在性腺中表达都具有两性差异:卵巢高于精巢[6,9,19-20,22],在半滑舌鳎精子发生关键时期,Rspo1在精巢中表达量出现上调,并高于卵巢,Rspo1在参与卵巢早期分化的同时可能也参与精子发生,所以在精子发生过程中出现上调[36]。本研究中Rspo1表达量在高温养殖和Letrozole诱导的性逆转精巢中均高于卵巢,推测Rspo1可能在参与卵巢分化的同时也参与淇河鲫精巢精子发生等过程,但也不能排除Rspo1在由雌性向雄性的性逆转过程中可能发挥了某种作用。
本研究成功克隆了淇河鲫Rspo1基因的cDNA,进行了系统进化分析,并对其在不同组织、不同发育时期的表达量进行了检测,同时检测了Letrozole、高温处理导致性逆转过程中Rspo1在性腺中的表达变化,为进一步探讨Rspo1基因在雌核发育鱼类性别决定与分化中的作用机制奠定基础。
| [1] |
Chassot A A, Gillot I, Chaboissier M C. R-spondin1, WNT4, and the CTNNB1 signaling pathway: strict control over ovarian differentiation[J].
Reproduction, 2014, 148(6): R97-R110 DOI: 10.1530/REP-14-0177 ( 0) 0)
|
| [2] |
Kim K A, Zhao J S, Andarmani S, et al. R-Spondin proteins: a novel link to β-catenin activation[J].
Cell Cycle, 2006, 5(1): 23-26 DOI: 10.4161/cc.5.1.2305 ( 0) 0)
|
| [3] |
Wilhelm D. R-spondin1-discovery of the long-missing, mammalian female-determining gene?
[J].
Bioessays, 2007, 29(4): 314-318 DOI: 10.1002/(ISSN)1521-1878 ( 0) 0)
|
| [4] |
Tomizuka K, Horikoshi K, Kitada R, et al. R-spondin1 plays an essential role in ovarian development through positively regulating Wnt-4 signaling[J].
Human Molecular Genetics, 2008, 17(9): 1278-1291 DOI: 10.1093/hmg/ddn036 ( 0) 0)
|
| [5] |
Kim Y, Kobayashi A, Sekido R, et al. Fgf 9 and Wnt4 act as antagonistic signals to regulate mammalian sex determination
[J].
PLoS Biology, 2006, 4(6): e187 DOI: 10.1371/journal.pbio.0040187 ( 0) 0)
|
| [6] |
Kocer A, Pinheiro I, Pannetier M, et al. R-spondin1 and FOXL2 act into two distinct cellular types during goat ovarian differentiation
[J].
BMC Developmental Biology, 2008, 8(1): 36 DOI: 10.1186/1471-213X-8-36 ( 0) 0)
|
| [7] |
Nef S, Vassalli J D. Complementary pathways in mammalian female sex determination[J].
Journal of Biology, 2009, 8(8): 74 DOI: 10.1186/jbiol173 ( 0) 0)
|
| [8] |
Parma P, Radi O, Vidal V, et al. R-spondin1 is essential in sex determination, skin differentiation and malignancy[J].
Nature Genetics, 2006, 38(11): 1304-1309 DOI: 10.1038/ng1907 ( 0) 0)
|
| [9] |
Smith C A, Shoemaker C M, Roeszler K N, et al. Cloning and expression of R-Spondin1 in different vertebrates suggests a conserved role in ovarian development
[J].
BMC Developmental Biology, 2008, 8(1): 72 DOI: 10.1186/1471-213X-8-72 ( 0) 0)
|
| [10] |
Lavery R, Chassot A A, Pauper E, et al. Testicular differentiation occurs in absence of R-spondin1 and Sox9 in mouse sex reversals[J].
PLoS Genetics, 2012, 8(12): e1003170 DOI: 10.1371/journal.pgen.1003170 ( 0) 0)
|
| [11] |
Chassot A A, Gregoire E P, Lavery R, et al. RSPO1/β-Catenin signaling pathway regulates oogonia differentiation and entry into meiosis in the mouse fetal ovary[J].
PLoS One, 2011, 6(10): e25641 DOI: 10.1371/journal.pone.0025641 ( 0) 0)
|
| [12] |
Chassot A A, Gregoire E P, Magliano M, et al. Genetics of ovarian differentiation: Rspo1, a major player
[J].
Sexual Development, 2008, 2(4-5): 219-227 DOI: 10.1159/000152038 ( 0) 0)
|
| [13] |
Jeays-Ward K, Hoyle C, Brennan J, et al. Endothelial and steroidogenic cell migration are regulated by WNT4 in the developing mammalian gonad[J].
Development, 2003, 130(16): 3663-3670 DOI: 10.1242/dev.00591 ( 0) 0)
|
| [14] |
Chassot A A, Bradford S T, Auguste A, et al. WNT4 and RSPO1 together are required for cell proliferation in the early mouse gonad[J].
Development, 2012, 139(23): 4461-4472 DOI: 10.1242/dev.078972 ( 0) 0)
|
| [15] |
Nam J S, Turcotte T J, Smith P F, et al. Mouse cristin/R-spondin family proteins are novel ligands for the Frizzled 8 and LRP6 receptors and activate β-catenin-dependent gene expression[J].
Journal of Biological Chemistry, 2006, 281(19): 13247-13257 DOI: 10.1074/jbc.M508324200 ( 0) 0)
|
| [16] |
Kim K A, Wagle M, Tran K, et al. R-Spondin family members regulate the Wnt pathway by a common mechanism[J].
Molecular Biology of the Cell, 2008, 19(6): 2588-2596 DOI: 10.1091/mbc.e08-02-0187 ( 0) 0)
|
| [17] |
Nicol B, Guiguen Y. Expression profiling of Wnt signaling genes during gonadal differentiation and gametogenesis in rainbow trout[J].
Sexual Development, 2011, 5(6): 318-329 DOI: 10.1159/000334515 ( 0) 0)
|
| [18] |
Wu G C, Chang C F. wnt4 is associated with the development of ovarian tissue in the protandrous black porgy, Acanthopagrus schlegeli
[J].
Biology of Reproduction, 2009, 81(6): 1073-1082 DOI: 10.1095/biolreprod.109.077362 ( 0) 0)
|
| [19] |
Zhang Y M, Li F, Sun D C, et al. Molecular analysis shows differential expression of R-spondin1 in zebrafish (Danio rerio) gonads
[J].
Molecular Biology Reports, 2011, 38(1): 275-282 ( 0) 0)
|
| [20] |
Zhou L Y, Charkraborty T, Yu X G, et al. R-spondins are involved in the ovarian differentiation in a teleost, medaka (Oryzias latipes)
[J].
BMC Developmental Biology, 2012, 12(1): 36 DOI: 10.1186/1471-213X-12-36 ( 0) 0)
|
| [21] |
Zhou L Y, Charkraborty T, Zhou Q, et al. Rspo1-activated signalling molecules are sufficient to induce ovarian differentiation in XY medaka (Oryzias latipes)
[J].
Scientific Reports, 2016, 6(1): 19543 DOI: 10.1038/srep19543 ( 0) 0)
|
| [22] |
Wu L M, Yang P, Luo F, et al. R-spondin1 signaling pathway is required for both the ovarian and testicular development in a teleosts, Nile tilapia (Oreochromis niloticus)
[J].
General and Comparative Endocrinology, 2016, 230-231: 177-185 DOI: 10.1016/j.ygcen.2016.04.001 ( 0) 0)
|
| [23] |
Zhang J, Sun M, Zhou L, et al. Meiosis completion and various sperm responses lead to unisexual and sexual reproduction modes in one clone of polyploid Carassius gibelio
[J].
Scientific Reports, 2015, 5: 10898 DOI: 10.1038/srep10898 ( 0) 0)
|
| [24] |
Kamata T, Katsube K I, Michikawa M, et al. R-spondin, a novel gene with thrombospondin type 1 domain, was expressed in the dorsal neural tube and affected in Wnts mutants
[J].
Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression, 2004, 1676(1): 51-62 DOI: 10.1016/j.bbaexp.2003.10.009 ( 0) 0)
|
| [25] |
De Lau W B, Snel B, Clevers H C. The R-spondin protein family[J].
Genome Biology, 2012, 13(3): 242 DOI: 10.1186/gb-2012-13-3-242 ( 0) 0)
|
| [26] |
Vainio S, Heikkilä M, Kispert A, et al. Female development in mammals is regulated by Wnt-4 signalling[J].
Nature, 1999, 397(6718): 405-409 DOI: 10.1038/17068 ( 0) 0)
|
| [27] |
Nam J S, Turcotte T J, Yoon J K. Dynamic expression of R-spondin family genes in mouse development
[J].
Gene Expression Patterns, 2007, 7(3): 306-312 DOI: 10.1016/j.modgep.2006.08.006 ( 0) 0)
|
| [28] |
Díaz N, Piferrer F. Lasting effects of early exposure to temperature on the gonadal transcriptome at the time of sex differentiation in the European sea bass, a fish with mixed genetic and environmental sex determination[J].
BMC Genomics, 2015, 16(1): 679 DOI: 10.1186/s12864-015-1862-0 ( 0) 0)
|
| [29] |
Valenzuela N, Neuwald J L, Literman R. Transcriptional evolution underlying vertebrate sexual development[J].
Developmental Dynamics, 2013, 242(4): 307-319 DOI: 10.1002/dvdy.23897 ( 0) 0)
|
| [30] |
Navarro-Martín L, Viñas J, Ribas L, et al. DNA methylation of the gonadal aromatase (cyp19a) Promoter is involved in temperature-dependent sex ratio shifts in the European Sea bass
[J].
PLoS Genetics, 2011, 7(12): e1002447 DOI: 10.1371/journal.pgen.1002447 ( 0) 0)
|
| [31] |
Yamaguchi T, Yamaguchi S, Hirai T, et al. Follicle-stimulating hormone signaling and Foxl2 are involved in transcriptional regulation of aromatase gene during gonadal sex differentiation in Japanese flounder, Paralichthys olivaceus
[J].
Biochemical and Biophysical Research Communications, 2007, 359(4): 935-940 DOI: 10.1016/j.bbrc.2007.05.208 ( 0) 0)
|
| [32] |
Fernandino J I, Hattori R S, Kimura H, et al. Expression profile and estrogenic regulation of anti-Müllerian hormone during gonadal development in pejerrey Odontesthes bonariensis, a teleost fish with strong temperature-dependent sex determination
[J].
Developmental Dynamics, 2008, 237(11): 3192-3199 DOI: 10.1002/dvdy.v237:11 ( 0) 0)
|
| [33] |
D'Cotta H, Fostier A, Guiguen Y, et al. Search for genes involved in the temperature-induced gonadal sex differentiation in the tilapia, Oreochromis niloticus
[J].
Journal of Experimental Zoology, 2001, 290(6): 574-585 DOI: 10.1002/(ISSN)1097-010X ( 0) 0)
|
| [34] |
Poonlaphdecha S, Pepey E, Canonne M, et al. Temperature induced-masculinisation in the Nile tilapia causes rapid up-regulation of both dmrt1 and amh expressions
[J].
General and Comparative Endocrinology, 2013, 193: 234-242 DOI: 10.1016/j.ygcen.2013.06.007 ( 0) 0)
|
| [35] |
Li X Y, Liu X L, Zhu Y J, et al. Origin and transition of sex determination mechanisms in a gynogenetic hexaploid fish[J].
Heredity, 2018, 121(1): 64-74 DOI: 10.1038/s41437-017-0049-7 ( 0) 0)
|
| [36] |
Li H L, Xu W T, Zhu Y, et al. Characterization and expression pattern of r‐spondin1 in Cynoglossus semilaevis
[J].
Journal of Experimental Zoology Part B: Molecular and Developmental Evolution, 2017, 328(8): 772-780 DOI: 10.1002/jezb.b.v328.8 ( 0) 0)
|
 2019, Vol. 43
2019, Vol. 43


