鱼类的生殖活动受脑神经激素的控制与调节,其调节轴分为下丘脑-垂体-性腺三个层次[1]。雌二醇(E2) 具有诱导肝脏合成卵黄蛋白原,调节碳水化合物和脂肪的代谢功能[2];睾酮(T) 则具有调节精子细胞分化,促进精子形成和排精的作用[3]。因此,研究E2和T含量的变化可以及时掌握银鲳性腺发育的状态,目前国内外已对许多鱼类的性类固醇激素开展了相关研究[4-10]。
银鲳(Pampus argenteus) 隶属于鲈形目(Perci-formes)、鲳亚目(Stromateoidei)、鲳科(Stroma-teidae)、鲳属(Pampus),是一种具有较高经济价值的食用性鱼类,近年来我国银鲳的野生资源量呈现不断下降的趋势,因此,亟需开展银鲳人工苗种繁育和养殖的工作。迄今,国内外关于银鲳的研究主要集中在营养成分[11]、生态毒理[12]、群体遗传学分析[13-14]、繁殖特性[15-16]、性腺发育[17-19]等方面。目前,虽然银鲳已可在人工调控条件下实现自行产卵,但国内外尚未见对养殖银鲳性腺周年发育过程中性类固醇激素变化规律的研究报道。本研究利用组织切片及酶联免疫吸附等方法,观察银鲳性腺发育特征和性类固醇激素的周年变化,旨在为进一步了解银鲳性腺发育过程的内分泌调控机制提供基础资料。
1 材料与方法 1.1 实验对象银鲳于2014年5月至2015年5月取自浙江象山鱼得水水产有限公司。从1月龄开始,每月定期随机取样20~25尾,繁殖期(3-5月) 每10~15 d采样1次,共采集样品鱼289尾,其中雌鱼154尾,雄鱼135尾。鱼体质量3.13~288.78 g,体长4.9~19.4 cm。实验鱼采用室内水泥池流水养殖,投喂由1/3日本产“鱼宝”+1/3海蜇+1/3蓝点马鲛(Scomberomorus niphonius) 鱼糜经反复搅拌成的自制团状饲料,日投喂4次。周年水温15.7~29.2 ℃、pH 8.0~8.3、盐度16~26。
1.2 实验方法血清及性腺采集 先根据肉眼初步观察,再在显微镜下复检,选择性腺发育基本同步的个体取样,称重后用1 mL无菌注射器从尾静脉取血,4 ℃下静置4~6 h,3000 r/min离心20 min后取上层血清,然后立即将鱼置于冰盘上解剖,取性腺组织的前、中、后部用Bouin’s液固定24 h后转入70%酒精保存。血清样品在48 h内完成测定。
性腺组织切片与分期 性腺组织采用常规石蜡切片技术,样品经酒精梯度脱水,二甲苯透明(Ⅴ期卵巢叔丁醇透明),石蜡包埋,苏木精-伊红染色,OLYMPUS-BX60显微镜观察并拍照。性腺发育分期参照楼允东[20]和刘筠[21]的方法,以切面中平均面积比例最高的生殖细胞时相来确定性腺的分期,并对每月样品的性腺分期进行统计后得到各期所占百分比。
性类固醇激素测定利用酶联免疫吸附法(Elisa),采用Molecular Devices SpectraMax M3多功能酶标仪测定血清中性类固醇激素含量,E2和T分析试剂盒为上海桥杜生物试剂公司生产。E2检测灵敏度为0.1 pg/mL,T检测灵敏度0.1 nmol/L,批内变异系数和批间变异系数分别小于9%和11%。实验操作均按照试剂盒的说明书进行。
1.3 数据统计及相关公式所得数据均表示为平均值±标准差(mean±SD)。采用Duncan′s test对E2和T表达水平、GSI值、HSI值、CF值进行单因素方差(One-Way ANOVA) 分析(SPSS软件, V19.0)。P < 0.05为差异显著。
相关计算公式:

|
上式中BW为去内脏重(g);BL为体长(cm);GW为性腺重(g);LW为肝脏重(g)。
2 结果 2.1 银鲳性腺发育周期变化规律养殖银鲳性腺发育具有周期性的规律(表 1)。5月份为Ⅰ期性腺,肉眼难以辨别雌雄;6-9月卵巢发育至Ⅱ期;11月份卵巢近一半发育至Ⅲ期,33.3%发育至Ⅳ期;12月至翌年1月,随着水温的降低,银鲳卵巢退化至Ⅱ期越冬;2月份卵巢重新发育至Ⅲ期;3月份卵巢迅速发育至Ⅳ期;4月份发育至成熟的Ⅴ期,外观上可见其腹部膨大的卵巢轮廓,与雄鱼体型明显不同。雌鱼产完一次卵后,卵巢进入Ⅵ~Ⅳ期,在适宜条件再次成熟产卵,产卵至5月底结束。
| 表 1 养殖银鲳各月性腺发育分期及所占样本数量百分比 Tab.1 The proportion of each stage gonad of P. argenteus |
银鲳精巢发育相比同月份的卵巢发育成熟早。6-7月精巢发育至Ⅱ期;8-9月精巢发育已至Ⅲ期;10月份精巢发育至Ⅳ期;11月份约20%已达到成熟的Ⅴ期精巢;12月至翌年2月则退化以Ⅲ期精巢越冬;3月份精巢重新发育至Ⅳ期;4月份精巢发育至Ⅴ期;5月份后显著退化吸收。
2.2 卵巢发育形态及组织学解剖发现,银鲳卵巢位于肾脏和消化道之间,发育成熟的卵巢呈一对“>”形左右对称的囊状结构,上叶呈短而尖细状,末端通过系膜与体腔背壁相连。下叶长且粗大钝圆,末端以输卵管与泄殖孔相通。银鲳卵巢发育根据不同发育时相卵母细胞的变化,可分为6期。
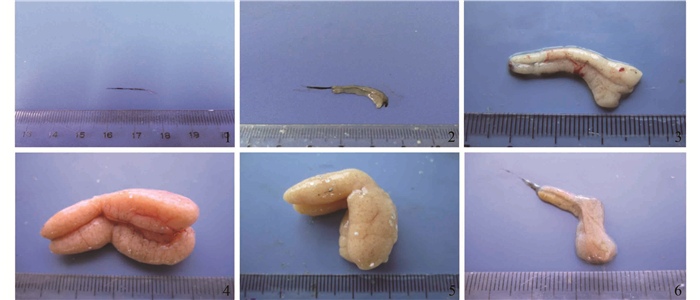
Ⅰ期卵巢:紧贴于体腔膜上,呈黑色细线状(图版 Ⅰ-1),视野内主要为第Ⅰ时相卵母细胞,由生殖上皮细胞分化而来的卵原细胞依附于生殖上皮中,呈椭圆或梨形,卵径13.4~48.7 μm;细胞核径7.84~21.29 μm,核外包被一层强嗜碱性的细胞质,H.E染色呈紫色,核内染色质染色呈红色,显嗜酸性(图版 Ⅱ-1)。
|
图版 Ⅰ 银鲳不同发育时期卵巢形态学 1.Ⅰ期卵巢; 2. Ⅱ期卵巢; 3. Ⅲ期卵巢; 4. Ⅳ期卵巢; 5. Ⅴ期卵巢; 6. Ⅵ期卵巢 Plate1 The morphology of ovary at different developmental stages of P. argenteus 1. the ovary in the stage Ⅰ; 2. the ovary in the stage Ⅱ; 3. the ovary in the stage Ⅲ; 4. the ovary in the stage Ⅳ; 5. the ovary in the stage Ⅴ; 6. the ovary in the stage Ⅵ |

|
图版 Ⅱ 银鲳不同发育时期卵巢组织学 1.第Ⅰ时相卵母细胞, ×400; 2. Ⅱ期卵巢, 示产卵板与第Ⅱ时相早期卵母细胞, ×200; 3.第Ⅱ时相晚期卵母细胞, 示核仁与卵黄核, ×1000; 4.第Ⅲ时相早期卵母细胞, 示液泡, ×400; 5.第Ⅲ时相中期卵母细胞, 示滤泡膜, ×400; 6.第Ⅲ时相晚期卵母细胞, 示卵黄颗粒和油滴, ×400; 7.第Ⅳ时相早期卵母细胞, ×400; 8.第Ⅳ时相中期卵母细胞, ×400; 9.第Ⅳ时相晚期卵母细胞, 示细胞核, ×200; 10.第Ⅴ时相卵母细胞, 示大油球, ×200; 11.第Ⅵ时相卵母细胞, 示Ⅱ、Ⅲ、Ⅳ时相卵细胞和空滤泡, ×200; 12.发生闭锁的卵母细胞, ×200. CO.产卵板; NU.核仁; YN.卵黄核; Ⅴ.液泡; FM.滤泡膜; ZR.放射膜; OD.油滴; YG.卵黄颗粒; N.核; Ob.油球; EF.空滤泡;BV.血管 Plate2 The ovarian histology of P. argenteus at different developmental stages 1. the oocyte at the phase Ⅰ, ×400; 2. ovary in the stage Ⅱ, showing the ovigerous folds and the oocyte at the early phase Ⅱ, ×200; 3. the oocyte at the late phase Ⅱ, showing the nucleus and yolk nucleus, ×1000; 4. the oocyte in the early phase Ⅲ, showing the vesicles, ×400; 5. the oocyte at the middle phase Ⅲ, showing the follicle membrane, ×400; 6. the oocyte at the late phase Ⅲ, showing the yolk globules and oil droplet, ×400; 7. the oocyte at the early phase Ⅳ, ×400; 8. the oocyte in the middle phase Ⅳ, ×400; 9. the oocyte at the late phase Ⅳ, showing the nucleus, ×200; 10. the oocyte at the phase Ⅴ, showing the oil globule, ×200; 11. the oocyte at the phase Ⅵ, showing the oocyte in the stage Ⅱ, Ⅲ, Ⅳ and the empty follicle, ×200. 12. oocyte with atresia, ×200. CO. ovigerous folds; NU. nucleolus; YN. yolk nucleus; Ⅴ. vacuole; FM: follicle membrane; ZR. zona radiate; OD. oil droplet; YG. yolk granules; N. nucleus; Ob. oil globule; EF. empty follicle; BV. blood vessel |
Ⅱ期卵巢:呈透明棒状(图版 Ⅰ-2)。切片显示该时期的卵巢主要由处于小生长期的第Ⅱ时相卵母细胞组成,同时还有少量卵原细胞存在。卵巢中产卵板形成,GSI为0.31%~0.85%。卵细胞呈椭圆形或圆形,核内存在4~17个大小不等的核仁,卵细胞的核占很大比例,核内的染色质呈细线状并结成稀疏的网。依据发育的形态特征可以将第Ⅱ时相卵母细胞分为早、中、晚三期。早期:卵母细胞近圆形,卵径53.31~76.85 μm,细胞质呈强嗜碱性,核径43.33~62.12 μm,细胞外周出现单层滤泡膜(图版 Ⅱ-2)。中期:卵径增大至79.01~86.46 μm,胞质嗜碱性减弱,核径51.12~67.23 μm,核仁沿核膜分布。晚期:细胞体积继续增大,卵径90.23~130.51 μm,核径62.46~73.25 μm,出现被染成深蓝色的椭圆形卵黄核(图版 Ⅱ-3)。
Ⅲ期卵巢:卵巢体积增大,膜上血管逐渐增多,透过卵巢膜可见细小的卵粒(图版 Ⅰ-3)。切片显示,此时卵巢主要由处于大生长期的第Ⅲ时相卵母细胞以及少部分第Ⅱ时相卵母细胞组成。在同一切面上,有10~28个沿核膜分布的核仁,GSI为0.91%~2.35%。第Ⅲ时相卵母细胞也可分为早、中、晚三期。早期:卵母细胞近球形,卵径124.92~155.78 μm,核径70.15~82.93 μm,核膜呈波纹状,凹凸不平。此时胞质中出现了一层排列松散,大小不一的液泡,滤泡膜从单层变成双层(图版 Ⅱ-4)。中期:卵径151.90~194.07 μm,核径80.78~108.93 μm;细胞质嗜酸性增强,液泡数目增多,体积增大,呈多层排列,在滤泡膜与质膜间可见嗜酸性的放射带,厚度约为0.98~1.13 μm (图版 Ⅱ-5)。晚期:卵母细胞继续增大,卵径达200.92~362.35 μm,核径103.93~138.67 μm;放射带厚度约为2.64~3.48 μm,在滤泡膜与放射带之间,出现一层薄的胶质膜结构;在质膜内出现油滴,卵膜边缘开始出现细小的卵黄颗粒沉积的现象(图版 Ⅱ-6)。
Ⅳ期卵巢:桔黄色囊状,呈“>”形,体积较Ⅲ期卵巢显著增大。肉眼可见部分为即将成熟的半透明卵粒,外膜的血管粗而发达(图版 Ⅰ-4)。切片显示,此时卵巢内存在第Ⅳ时相卵母细胞以及一定数量的第Ⅱ、Ⅲ时相卵母细胞,核仁数量减少并消失。GSI为2.88%~9.72%。根据卵径、卵黄物质及核位置的变化等,可将卵母细胞分为早、中、晚三期。早期:卵母细胞体积继续增大,卵径达328.91~508.55 μm,核径115.79~143.10 μm,放射带厚度约为3.55~6.73 μm,卵黄颗粒迅速增多,分布于质膜边缘的胞质中,脂滴分布于核周围,脂滴层与卵黄颗粒层之间的界线分明(图版 Ⅱ-7)。中期:卵径达489.81~555.18 μm,核径127.28~214.95 μm,卵黄颗粒继续增多,并向核周分布聚集,与脂滴交错分布(图版 Ⅱ-8)。晚期:卵径达438.06~648.93 μm,核径178.63~256.78 μm,卵黄颗粒已经充满卵母细胞,脂滴逐渐融合成较大的油球,放射带基本消失,胶质膜厚度约为6.62~10.42 μm,一些卵母细胞的细胞核开始移向动物极(图版 Ⅱ-9),表明卵母细胞的生长期已完成,此时达到生长成熟。
Ⅴ期卵巢:占据腹腔大部分体积,呈淡黄色,松软而膨大,血管发达(图版 Ⅰ-5),卵粒大而透明,呈游离状充满卵巢,轻压雌鱼腹部有成熟的卵流出,此时卵巢已达生理成熟。切片显示,Ⅴ时相卵母细胞中的卵黄颗粒粗大,互相融合成块状,在细胞中出现大油球(图版 Ⅱ-10),此时卵径达624.03~908.43 μm,油球径226.23~340.67 μm,胶质膜厚度约为13.15~17.42 μm,除Ⅴ时相卵母细胞外,一定量的Ⅱ、Ⅲ、Ⅳ时相卵母细胞也存在于卵巢中。
Ⅵ期卵巢:此时卵巢产卵完毕,体积减小并变得松弛(图版 Ⅰ-6),切片观察卵巢中有一定数量的第Ⅱ、Ⅲ、Ⅳ时相卵母细胞和空滤泡(图版 Ⅱ-11),还有将退化的卵母细胞,Ⅱ时相外周为单层滤泡膜,无卵黄物质,Ⅲ时相卵母细胞内出现卵黄物质,Ⅳ时相卵母细胞卵黄颗粒较多(图版 Ⅱ-12)。
2.3 精巢发育形态及组织学银鲳具一对左右对称的精巢,位于肾脏腹面、消化道的背侧,形状同卵巢相似,但体积明显小于卵巢。根据精巢发育过程中生精细胞变化及其特点,可将精巢划分为6期。
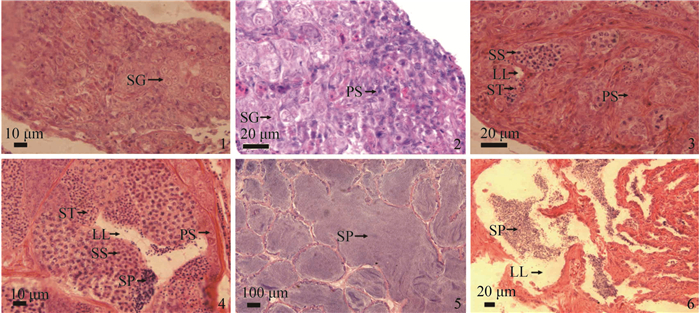
Ⅰ期精巢:呈透明细线状,位于黑色的腹膜中,肉眼难分雌雄(图版 Ⅲ-1)。切片观察显示,精巢内的生殖细胞以精原细胞为主。该细胞体积较大,呈不规则的圆形,胞径8.05~12.03 μm,核径5.84~8.46 μm,胞质染色浅,弱嗜碱性(图版 Ⅳ-1)。

|
图版 Ⅲ 银鲳不同发育时期精巢形态学 1. Ⅰ期精巢; 2. Ⅱ期精巢; 3. Ⅲ期精巢; 4. Ⅳ期精巢; 5. Ⅴ期精巢; 6. Ⅵ期精巢 Plate3 The morphology of testis at different developmental stages of P. argenteus 1. the testis in the stage Ⅰ; 2. the testis in the stage Ⅱ; 3. the testis in the stage Ⅲ; 4. the testis in the stage Ⅳ; 5. the testis in the stage Ⅴ; 6. the testis in the stage Ⅵ |
|
图版 Ⅳ 银鲳不同发育时期精巢组织学切片 1. Ⅰ期精巢, 示精原细胞, ×1000; 2. Ⅱ期精巢, 示精原细胞和初级卵母细胞, ×1000; 3. Ⅲ期精巢, 示初级卵母细胞、次级精母细胞、精子细胞与小叶腔, ×1000; 4. Ⅳ期精巢, 示初级卵母细胞、次级精母细胞、精子细胞、精子和小叶腔, ×1000; 5. Ⅴ期精巢, 示小叶腔中充满精子, ×100; 6. Ⅵ期精巢, 示精子、小叶腔, ×400. SG.精原细胞; PS.初级精母细胞; SS.次级精母细胞; ST.精子细胞; SP.精子; LL.小叶腔 Plate4 Histological sections of the testis of P. argenteus at different developmental stages 1. testis in the stage Ⅰ, showing the spermatogonia, ×1000; 2. testis in the stage Ⅱ, showing the spermatogonia, primary spermatocyte, ×1000; 3. testis in the stage Ⅲ, showing the primary spermatocyte, secondary spermatocyte, spermatid and lobule lumen, ×1000; 4. testis in the stage Ⅳ, showing the primary spermatocyte, secondary spermatocyte, spermatid, spermatozoa and lobule lumen, ×1000; 5. testis in the stage Ⅴ, showing the complete mature spermatozoa in the lobule lumen, ×100; 6. testis in the stage Ⅵ, showing the spermatozoa and lobule lumen, ×400. SG. spermatogonia; PS. primary spermatocyte; SS. secondary spermatocyte; ST. spermatid; SP. spermatozoa; LL. lobule lumen |
Ⅱ期精巢:呈半透明的细带状(图版 Ⅲ-2)。精小叶中主要存在排列紧密的精原细胞和初级精母细胞(图版 Ⅳ-2)。初级精母细胞由精原细胞分裂而来,呈圆形或椭圆形,初级精母细胞直径小于精原细胞,胞径5.86~7.93 μm,核内染色质丰富并浓缩成团块状,呈嗜碱性,染色程度较精原细胞深。
Ⅲ期精巢:体积增大,呈灰白色条带状(图版 Ⅲ-3)。切片显示,精小叶出现空腔,小叶内存在精原细胞、初级精母细胞、次级精母细胞及精子细胞(图版 Ⅳ-3)。精原细胞和初级精母细胞沿精小叶边缘单层或多层排列,次级精母细胞体积更小,胞径3.08~4.06 μm,细胞核的嗜碱性增强,染色更深,精子细胞由次级精母细胞经过第二次成熟分裂而成,胞径2.21~2.96 μm,只有强嗜碱性的核,着色深。
Ⅳ期精巢:白玉色囊状(图版 Ⅲ-4),精小囊体积明显增大,此时精小叶中可以看到由初级精母细胞、次级精母细胞、精子细胞及精子组成的精小囊。精子头部染色深,朝向管壁或位于官腔中,尾细如丝(图版 Ⅳ-4)。
Ⅴ期精巢:体积最大,轻压腹部可见泄殖孔中有乳白色精液流出(图版 Ⅲ-5)。切片显示,此时精小囊破裂,精子排入小叶腔中,小叶腔中充满发育成熟的精子(图版 Ⅳ-5),精子通过输精管排出。精子直径1.12~1.68 μm,染色后呈深蓝色。
Ⅵ期精巢:呈松软萎缩状,体积减小(图版 Ⅲ-6),切片显示,此时大部分精子已经排出,精小叶呈空囊状,仅残留少量的精子,精小叶壁主要由精原细胞和初级精母细胞组成(图版 Ⅳ-6)。
2.4 性腺发育的数量特征变化室内人工养殖条件下,银鲳雌鱼GSI值的周年变化范围为0.19%~12.89%(图 1),从5月到10月上升极缓慢,11月份显著升高,达到第一个峰值,为6.84%;然而,从12月至翌年1月显著降低(P < 0.05),2月后开始重新上升,GSI值在3月份(Ⅳ期) 显著升高(P < 0.05),并在4月份卵巢发育至Ⅴ期时达到最高值12.89%,是第一峰值的1.88倍,5月份繁殖过后GSI值显著下降(P < 0.05)。雄鱼的GSI值在0.08%~2.62%之间波动,周年变化趋势和雌鱼基本一致,但数值及变化幅度显著低于雌鱼。

|
图 1 银鲳GSI的周年变化(2014-2015) Fig. 1 Year-round gonadosomatic index variation in P. argenteus (2014-2015) |
雌鱼的HSI值从5月份的0.97%逐渐上升到11月份第一个峰值2.30%;随着水温下降,12月至翌年2月逐渐降至1.68%~1.93%的较低水平;3月份再次显著升高(P < 0.05) 至2.17%,接近11月的水平,4月份再次显著下降(P < 0.05) 至1.62% (图 2)。雄鱼的HSI变化趋势与雌鱼基本一致,但HSI均值显著低于雌性(P < 0.05),雌鱼HSI的周年变化范围为0.97%~2.30%,均值为1.73%,雄鱼HSI值的周年变化范围为0.73%~1.83%,均值为1.48%。HSI值均在Ⅰ期水平最低,逐渐升高并于Ⅳ期达到峰值,Ⅴ期繁殖时显著下降并保持在较低水平至产后Ⅵ期。

|
图 2 银鲳HSI的周年变化(2014-2015) Fig. 2 Year-round hepatosomatic index variation in P. argenteus (2014-2015) |
雌鱼的CF值从5月到11月呈现出缓慢上升的趋势,11月份达到最大值,为3.08 g/cm3,从12月开始回落,并基本保持相对稳定直至翌年3月份,4月份显著下降(P < 0.05)。雌鱼的CF在2.30~3.08 g/cm3范围内波动,雄鱼的CF值略低于雌鱼,为2.11~2.80 g/cm3,同样从5月到11月逐渐上升,12月至翌年5月变化无显著差异(P > 0.05) (图 3)。雌雄鱼CF值均在Ⅰ期水平最低,逐渐升高并于Ⅳ期达到峰值,雌鱼的CF值在Ⅴ期繁殖时显著下降,雄鱼CF值在Ⅴ期下降不显著(P > 0.05)。

|
图 3 银鲳CF的周年变化(2014-2015) Fig. 3 Year-round condition factor variation in P. argenteus (2014-2015) |
银鲳性腺发育过程中,雌鱼血清中E2周年表达水平在23.27~59.13 pg/mL范围内波动,雄鱼的E2为15.90~36.20 pg/mL (图 4)。雌鱼血清中E2表达水平从5月份的23.27 pg/mL逐渐上升至11月份的50.83 pg/mL,上升了1.18倍,但12月比11月下降了16.4%,1月继续下降至36.20 pg/mL,3月份显著升高(P < 0.05),达到全年最大值59.13 pg/mL;4月份再次显著下降(P < 0.05),为35.05 pg/mL。雄鱼血清中E2表达水平显著低于雌鱼,但变化规律与雌鱼类似,从5月到11月逐渐上升,11月E2达到最高值,约为同期雌鱼的72%,12月至翌年4月E2表达水平无显著差异(P > 0.05)。

|
图 4 银鲳血清中E2含量周年变化 Fig. 4 Year-round changes of serum 17 β-estradiol levels in P. argenteus |
雌鱼血清中T周年表达水平为14.57~68.67 nmol/L,雄鱼的T周年表达水平为18.62~66.49 nmol/L (图 5)。雌鱼血清中T表达水平从5月份开始升高,11月份达到第一个峰值36.15 nmol/L,12月份后略有下降,翌年1月至3月维持在31.88~34.03 nmol/L的水平,4月份骤然升高(P < 0.05),达到最高值68.67 nmol/L。雄鱼的T水平变化规律与雌鱼类似,一年出现两次峰值,11月达到第一次峰值43.36 nmol/L,翌年4月达到全年最大值66.49 nmol/L,是第一峰值的1.53倍。

|
图 5 银鲳血清中T含量周年变化 Fig. 5 Year-round changes of serum testosterone levels in P. argenteus |
统计分析表明,雌鱼的E2与HSI (r=0.940, P < 0.05) 及CF (r=0.871, P < 0.05) 呈显著正相关关系;T和GSI也存在显著的正相关关系(r=0.911, P < 0.05)。雄鱼的E2与GSI、HSI和CF变化呈显著正相关关系(GSI, r=0.671, P < 0.05; HSI, r=0.664, P < 0.05; CF, r=0.938, P < 0.05);T与GSI和CF变化也呈显著正相关关系(GSI, r=0.965, P < 0.05; CF, r=0.651, P < 0.05)。
3 讨论 3.1 银鲳性腺发育特征银鲳性腺的形态特征与同为鲳科鲳属的灰鲳(P. cinereus)[16,22]相同,前端细长后端膨大,紧贴于肾脏腹面两侧。鉴于银鲳与灰鲳性腺结构特征均呈“>”形,依其在体腔中的前后位置,认为将前端描述为“上叶”,后端描述为“下叶”更为确切。人工养殖条件下多数银鲳个体一周年就可达到性成熟并产卵。卵巢在11月份即可发育至Ⅲ期,少部分个体甚至已发育至Ⅳ期,此时精巢中存在完成变态的精子,部分雄鱼挤压腹部有乳白色的精液流出。越冬期间(12月至翌年1月) 卵巢和精巢分别退化至Ⅱ期和Ⅲ期。翌年2-3月是性腺快速发育的时期,4月份大部分个体性腺发育进入Ⅴ期,达到成熟。与鲈(Lateolabrax maculatus)[6]、鳓(Ilisha elongata)[23]等分批产卵的鱼类一样,Ⅱ时相和Ⅲ时相的卵母细胞仍存在于Ⅳ期卵巢中,当产完卵后,在卵巢空滤泡间还有一定数量的Ⅱ、Ⅲ和Ⅳ时相卵母细胞(图版 Ⅱ-11),体现了卵母细胞具有可持续发育的能力[24]。在亲鱼人工养殖中也证实,银鲳在繁殖期内自然产出一批卵后一周左右即可产下一批卵,众多亲鱼分批产卵使日产卵量在产卵高峰时没有太大变化。因此,银鲳为分批非同步产卵类型,这与Almatar等[15]报道的科威特水域银鲳繁殖特点一致。
龚启祥等[17]和孙鹏[18]等分别观察了野生和养殖银鲳卵巢发育的组织学变化,指出银鲳卵巢成熟系数只在5月份有一个峰值,但本研究中发现银鲳卵巢发育周年变化中性成熟系数有两次高峰,分别在11月份和翌年4月份,且部分雄鱼在11月份(7月龄) 即可达到第一次性成熟,从卵巢和精巢的组织学及类固醇激素水平变化上也得到了印证。这说明在营养和环境适宜的人工饲养条件下,养殖银鲳将来有可能实现秋季提前产卵繁殖。同时,还发现在人工养殖条件下,部分银鲳卵巢切片中存在卵巢闭锁的现象,且多在第Ⅲ时相以后的卵母细胞中发生,表现为卵母细胞包围、镶嵌在其他成熟的卵母细胞中,呈现空泡化的状态,细胞质瓦解,卵黄物质被吞噬(图版 Ⅱ-12),这种现象在金钱鱼(Scatophagus argus)[25]中也存在。造成这种闭锁现象的原因可能是环境胁迫,也可能是卵巢在发育过程中必需营养物质的缺乏等。因此,在银鲳人工培育过程中,应采用适当的环境因子调控措施,尽量减少环境变化带来的应激,加强饵料营养的强化,提高亲鱼的成熟率和产卵率。
3.2 性类固醇激素表达对性腺发育的促进作用虽然鱼类的性类固醇激素水平受物种、环境、检测方法等因素的影响,但本研究结果显示银鲳雌、雄鱼性类固醇激素水平在不同月份具有显著的统计学差异。在银鲳卵巢发育过程中,雌鱼血清中的E2含量在Ⅳ期(3月) 时达到最高值(P < 0.05),在进入产卵期(4月) 下降并保持在较低水平至产卵后Ⅵ期,这与虹鳟(Oncorhynchus mykiss)[7]的变化趋势相同。E2在鱼类性腺发育的不同阶段起不同的生理作用,在卵黄合成之前,E2可与脑垂体分泌的促性腺激素起协同作用,促进卵母细胞的增殖。在卵黄生成期,E2诱导肝脏合成卵黄蛋白原促进卵母细胞内卵黄的积累,参与糖类和脂类代谢的调节。在卵母细胞成熟和排卵前,E2对脑垂体促性腺激素的分泌起负反馈作用,此时E2含量明显下降[26]。雄鱼血清中E2明显低于雌鱼,且周年变化不大,这和精巢发育过程中不需要卵黄蛋白的合成有关,然而研究结果显示雄鱼血清中E2水平与精巢GSI呈显著性正相关,这可能和E2在雄鱼的精巢中对于离子的转运、维持精子分化等方面起到必不可少的作用有关。统计分析结果显示,E2含量的变化与HSI值和CF值的变化呈现显著的正相关关系,表明养殖银鲳血清中E2对性腺发育成熟的内分泌调节与肝脏能量转化和鱼体的生长发育密切相关。
雌鱼血清中T含量在性腺发育至Ⅴ期(4月) 时达到峰值,晚于血清中E2峰值出现的时间,且略高于雄鱼的含量。在对半滑舌鳎(Cynoglossus semi-laevis)[8]的研究中呈现类似规律,其原因可能是雌鱼T作为E2的前体并能在芳香化酶的作用下转化为E2,卵黄积累末期,芳香化酶的活性减弱,使得T含量升高[9]。本研究中雄鱼T的变化同精巢的发育基本一致,在发育至Ⅴ期(11月和4月) 时T维持在较高水平。Aida[27]已研究证明,T具有调节精子细胞分化的作用,因此T表达水平在繁殖季节的升高对于促进精子形成和排精具有重要作用。T表达水平的变化和GSI值变化呈现出显著的正相关关系,说明血清中T对性腺的发育起到显著的促进作用。
3.3 GSI、HSI、CF变化与性腺发育的关系本研究中,银鲳GSI值在第一次周年发育过程中出现两次峰值,分别为11月份和翌年4月份,且4月份的GSI值比11月份的高,12月-翌年1月越冬期间银鲳性腺随着水温的降低出现退化现象,GSI值也随之维持在较低水平,这种发育后退化的现象在黄姑鱼(Nibea albiflora)[28]中也出现,一般认为由于水温较低,鱼类摄食减少导致其生长缓慢,其性腺发育停滞甚至出现退化[29]。HSI和CF的变化与性腺的发育密切相关,HSI在11月份和3月份达到峰值,表明此时期肝脏生长迅速,大量积累肝糖元等能量,用于合成和分泌卵黄蛋白原,这和Ⅳ期卵巢组织切片中观察到卵黄颗粒迅速增多的现象相一致。产卵时及繁殖后期HSI值降低,主要和该时期卵黄物质停止积累,肝脏代谢活动降低有关[30]。银鲳的CF值在早期增长较快,说明早期以生长为主,后期CF值变化相对平缓,进入以性腺发育为主的阶段,这和李春广等[10]对条斑星鲽(Verasper moseri) 的研究结果相一致,体现出银鲳的生长和繁殖能量分配策略。因此在银鲳亲鱼培育中,要加强越冬期的饵料营养,保证开春后亲鱼性腺发育所需的能量物质,并且在产卵结束后要对亲鱼细心管理,以便HSI和CF值较快地恢复。
| [1] |
Merson R R, Casey C S, Martinez C, et al. Oocyte development in summer flounder: seasonal changes and steroid correlates[J].
Journal of Fish Biology, 2000, 57(1): 182-196 DOI: 10.1111/jfb.2000.57.issue-1 ( 0) 0)
|
| [2] |
雷霁霖.
海水鱼类养殖理论与技术[M]. 北京: 中国农业出版社, 2005: 53-61.
Lei J L. Marine Fish Culture Theory and Techniques[M]. Beijing: China Agriculture Press, 2005: 53-61. (  0) 0)
|
| [3] |
Cochran R C. In vivo and in vitro evidence for the role of hormones in fish spermatogenesis[J].
Journal of Experimental Zoology, 1992, 261(2): 143-150 DOI: 10.1002/(ISSN)1097-010X ( 0) 0)
|
| [4] |
Morandini L, Ramallo M R, Moreira R G, et al. Serotonergic outcome, stress and sexual steroid hormones, and growth in a South American cichlid fish fed with an L-tryptophan enriched diet[J].
General and Comparative Endocrinology, 2015, 223: 27-37 DOI: 10.1016/j.ygcen.2015.10.005 ( 0) 0)
|
| [5] |
Mazón M J, Molés G, Rocha A, et al. Gonadotropins in European sea bass: endocrine roles and biotechnological applications[J].
General and Comparative Endocri-nology, 2015, 221: 31-41 DOI: 10.1016/j.ygcen.2015.05.002 ( 0) 0)
|
| [6] |
Lee W K, Yang S W. Relationship between ovarian development and serum levels of gonadal steroid hormones, and induction of oocyte maturation and ovulation in the cultured female Korean spotted sea bass Lateolabrax maculatus (Jeom-nong-eo)[J].
Aquaculture, 2002, 207(1-2): 169-183 DOI: 10.1016/S0044-8486(01)00728-1 ( 0) 0)
|
| [7] |
谷伟, 徐革锋, 户国, 等. 虹鳟(Oncorhynchus mykiss) 选育群体的血清类固醇激素周年变化[J].
海洋与湖沼, 2013, 44(3): 697-701 Gu W, Xu G F, Hu G, et al. Seasonal changes of serum steroid levels in rainbow trout (Oncorhynchus mykiss) of the selection population[J]. Oceanologia et Limnologia Sinica, 2013, 44(3): 697-701 (  0) 0)
|
| [8] |
徐永江, 柳学周, 王清印, 等. 半滑舌鳎(Cynoglossus semilaevis) 血浆性类固醇激素表达与卵巢发育及温光调控的关系研究[J].
海洋与湖沼, 2011, 42(1): 67-74 Xu Y J, Liu X Z, Wang Q Y, et al. Relationships between serum sex steriods levels and gonadal development and photothermal regulation during the annual maturation of captive Cynoglossus semilaevis Günther[J]. Oceanologia et Limnologia Sinica, 2011, 42(1): 67-74 (  0) 0)
|
| [9] |
Chang C F, Hung C Y, Chiang M C, et al. The concentrations of plasma sex steroids and gonadal aromatase during controlled sex differentiation in grey mullet, Mugil cephalus[J].
Aquaculture, 1999, 177(1-4): 37-45 DOI: 10.1016/S0044-8486(99)00067-8 ( 0) 0)
|
| [10] |
李春广, 柳学周, 徐永江, 等. 条斑星鲽精巢年周期发育规律和血液性类固醇激素含量变化[J].
渔业科学进展, 2012, 33(3): 35-41 Li C G, Liu X Z, Xu Y J, et al. Annual maturation of testis correlated with sex steroids level in male barfin flounder broodstocks[J]. Progress in Fishery Sciences, 2012, 33(3): 35-41 (  0) 0)
|
| [11] |
徐善良, 王丹丽, 徐继林, 等. 东海银鲳(Pampus argteus)、灰鲳(P. cinereus) 和中国鲳(P. sinsis) 肌肉主要营养成分分析与评价[J].
海洋与湖沼, 2012, 43(4): 775-782 Xu S L, Wang D L, Xu J L, et al. Analysis and evaluation of nutritional components in muscle of Pampus argenteus, P. cinereus and P. sinensis from the East China Sea[J]. Oceanologia et Limnologia Sinica, 2012, 43(4): 775-782 (  0) 0)
|
| [12] |
周健恺, 徐善良, 邱成功, 等. Cu2+急性毒性下银鲳幼鱼红细胞核异常和抗氧化酶活性的变化[J].
水产学报, 2014, 38(8): 1106-1112 Zhou J K, Xu S L, Qiu C G, et al. Effcts of Cu2+ on acute toxicity, blood cell nuclear abnormal and antioxidant enzyme activity of Pampus argenteus[J]. Journal of Fisheries of China, 2014, 38(8): 1106-1112 (  0) 0)
|
| [13] |
彭士明, 施兆鸿, 侯俊利. 基于线粒体D-loop区与COI基因序列比较分析养殖与野生银鲳群体遗传多样性[J].
水产学报, 2010, 34(1): 19-25 Peng S M, Shi Z H, Hou J L. Comparative analysis on the genetic diversity of cultured and wild silver pomfret populations based on mt D-loop and COI gene[J]. Journal of Fisheries of China, 2010, 34(1): 19-25 DOI: 10.3724/SP.J.1231.2010.06384 (  0) 0)
|
| [14] |
赵峰, 庄平, 章龙珍, 等. 基于线粒体Cyt b基因的黄海南部和东海银鲳群体遗传结构分析[J].
水生生物学报, 2011, 35(5): 745-752 Zhao F, Zhuang P, Zhang L Z, et al. Population genetic structure of Pampus argenteus in the South Yellow Sea and East China Sea based on the mitochondrial Cyt b sequence[J]. Acta Hydrobiologica Sinica, 2011, 35(5): 745-752 (  0) 0)
|
| [15] |
Almatar S M, Lone K P, Abu-Rezq T S, et al. Spawning frequency, fecundity, egg weight and spawning type of silver pomfret, Pampus argenteus (Euphrasen) (Stromateidae), in Kuwait waters[J].
Journal of Applied Ichthyology, 2004, 20(3): 176-188 DOI: 10.1111/jai.2004.20.issue-3 ( 0) 0)
|
| [16] |
施兆鸿, 高露姣, 谢营梁, 等. 舟山渔场银鲳和灰鲳繁殖特性的比较[J].
水产学报, 2006, 30(5): 647-653 Shi Z H, Gao L J, Xie Y L, et al. Comparison of reproductive characteristics between Pampus argenteus and Pampus cinereuc in Zhoushan fishing ground[J]. Journal of Fisheries of China, 2006, 30(5): 647-653 (  0) 0)
|
| [17] |
龚启祥, 倪海儿, 李伦平, 等. 东海银鲳卵巢周年变化的组织学观察[J].
水产学报, 1989, 13(4): 316-325 Gong Q X, Ni H E, Li L P, et al. On the change of the ovary in annual cycle of silver pomfret Stromateoides argenteus from the East China Sea[J]. Journal of Fisheries of China, 1989, 13(4): 316-325 (  0) 0)
|
| [18] |
孙鹏, 尹飞, 施兆鸿, 等. 养殖银鲳卵巢发育的组织学观察[J].
中国水产科学, 2013, 20(2): 293-298 Sun P, Yin F, Shi Z H, et al. Histological analysis of ovary development in the cultured silver pomfret, Pampus argenteus[J]. Journal of Fishery Sciences of China, 2013, 20(2): 293-298 DOI: 10.3724/SP.J.1118.2013.00293 (  0) 0)
|
| [19] |
孙鹏, 李云航, 尹飞, 等. 养殖银鲳第一次性周期性腺发育组织学[J].
海洋渔业, 2012, 34(4): 393-399 Sun P, Li Y H, Yin F, et al. Gonadal development of cultured Pampus argenteus in their first year of life[J]. Marine Fisheries, 2012, 34(4): 393-399 (  0) 0)
|
| [20] |
楼允东.
组织胚胎学[M]. 北京: 中国农业出版社, 1996: 126-137.
Lou Y D. Histology and Embryology[M]. Beijing: China Agriculture Press, 1996: 126-137. (  0) 0)
|
| [21] |
刘筠.
中国养殖鱼类繁殖生理学[M]. 北京: 中国农业出版社, 1993: 23-32.
Liu Y. Propagation Physiology of Main Cultivated Fish in China[M]. Beijing: China Agriculture Press, 1993: 23-32. (  0) 0)
|
| [22] |
施兆鸿, 罗海忠, 高露姣, 等. 灰鲳卵巢发育的组织学研究[J].
海洋水产研究, 2006, 27(4): 1-5 Shi Z H, Luo H Z, Gao L J, et al. Study on histology of ovary development of Pampus cinereus[J]. Marine Fisheries Research, 2006, 27(4): 1-5 (  0) 0)
|
| [23] |
倪海儿, 杜立勤. 东海鳓卵巢发育的组织学观察[J].
水产学报, 2001, 25(4): 317-322 Ni H E, Du L Q. Observation on the ovary development of Ilisha elongata in the East China Sea[J]. Journal of Fisheries of China, 2001, 25(4): 317-322 (  0) 0)
|
| [24] |
Arocha F. Oocyte development and maturity classification of swordfish from the north-western Atlantic[J].
Journal of Fish Biology, 2002, 60(1): 13-27 DOI: 10.1111/jfb.2002.60.issue-1 ( 0) 0)
|
| [25] |
崔丹, 刘志伟, 刘南希, 等. 金钱鱼性腺发育及其组织结构观察[J].
水产学报, 2013, 37(5): 696-704 Cui D, Liu Z W, Liu N X, et al. Histological study on the gonadal development of Scatophagus argus[J]. Journal of Fisheries of China, 2013, 37(5): 696-704 DOI: 10.3724/SP.J.1231.2013.38442 (  0) 0)
|
| [26] |
林浩然.
鱼类生理学[M]. 广州: 广东高等教育出版社, 2007: 202-210.
Lin H R. Fish Physiology[M]. Guangzhou: Guangdong Higher Education Press, 2007: 202-210. (  0) 0)
|
| [27] |
Aida K. Effect of LH-releasing hormone on gonadal development in a salmonoid fish, the ayu[J].
Nippon Suisan Gakkaishi, 1983, 49(5): 711-718 DOI: 10.2331/suisan.49.711 ( 0) 0)
|
| [28] |
马世磊, 耿智, 徐冬冬, 等. 黄姑鱼性腺发育的组织学观察[J].
浙江海洋学院学报(自然科学版), 2014, 33(2): 129-133 Ma S L, Geng Z, Xu D D, et al. Histological observations on the gonadal development of Nibea albiflora[J]. Journal of Zhejiang Ocean University (Natural Science), 2014, 33(2): 129-133 (  0) 0)
|
| [29] |
温海深, 林浩然. 环境因子对硬骨鱼类性腺发育成熟及其排卵和产卵的调控[J].
应用生态学报, 2001, 12(1): 151-155 Wen H S, Lin H R. Effect of environmental factors on gonadal maturation as well as its ovulation and spawning in teleosts[J]. Chinese Journal of Applied Ecology, 2001, 12(1): 151-155 (  0) 0)
|
| [30] |
Tyler C R, Sumpter J P, Witthames P R. The dynamics of oocyte growth during vitellogenesis in the rainbow trout (Oncorhynchus mykiss)[J].
Biology of Reproduction, 1990, 43(2): 202-209 DOI: 10.1095/biolreprod43.2.202 ( 0) 0)
|
 2017, Vol. 41
2017, Vol. 41


