鲤(Cyprinus carpio)疱疹病毒Ⅱ型(Cyprinid herpesvirus 2,CyHV-2),又称为疱疹病毒性造血器官坏死症病毒(herpesviral haematopoietic necrosis virus,HVHNV)[1]或金鱼(Carassius auratus)造血器官坏死症病毒(goldfish haematopoietic necrosis virus,GFHNV)[2],与鲤痘疮病毒(Cyprinid herpesvirus 1,又称鲤疱疹病毒I型,CyHV-1)、锦鲤疱疹病毒(Koi herpesvirus,KHV,又称鲤疱疹病毒III型,CyHV-3)同属异疱疹病毒科(Alloherpesviridae)鲤疱疹病毒属(Cyprinivirus)成员[3, 4]。CyHV-2核衣壳呈六边形,完整的病毒颗粒具有皮质层(tegument)和囊膜(envelope),呈圆形,直径为170~200 nm[3]。CyHV-2感染养殖鲫(Carassius auratus)引起的鲫造血器官坏死症是近年来我国新出现的一种严重传染性疾病,患病鲫的主要临床症状为体表广泛性充血或出血、鳃丝肿胀,充血或出血,解剖发现患病鲫主要内脏器官充血严重,该病致死率高达90%~100%,给我国鲫养殖产业造成了巨大的经济损失[5, 6]。
CyHV-2于1995年首次在日本患病金鱼体内发现,给日本西部金鱼养殖业造成了重大经济损失,患病金鱼死亡率高达100%[1]。随后美国、中国、澳大利亚、英国、捷克等国家也相继有了该病暴发的报道[4, 5]。匈牙利学者首次报道了在养殖的银鲫(C. auratus gibelio)体内检测到CyHV-2[7],捷克和意大利学者也报道了CyHV-2感染养殖鲫并引起大量死亡的病例[8, 9]。2012年Wang等[10]首次报道了我国东部地区池塘养殖异育银鲫感染CyHV-2的病例。随后,北京、武汉、广州等地养殖异育银鲫体内也检测到CyHV-2,证实该病毒在我国分布广泛[11, 12]。迄今为止,由于缺乏该病毒的敏感细胞系,严重制约了对该病毒及其所致疾病的深入研究[5, 6]。本实验室利用新建立的CyHV-2敏感细胞系——异育银鲫脑组织细胞系(GiCB)[6],对CyHV-2的理化及生物学特性进行了详细的研究,比较了不同来源鱼类细胞系对CyHV-2感染的敏感性,并利用电子显微镜技术研究了体外培养细胞中CyHV-2的形态发生过程,旨在为深入研究CyHV-2的感染及致病机理以及鲫造血器官坏死症的发病原因和防控技术奠定前期基础。
1 材料与方法 1.1 病毒、细胞系与主要试剂异育银鲫脑组织细胞系GiCB为本实验室建立并保存[6]。鲤疱疹病毒Ⅱ型流行株为本实验室分离鉴定并保存[5]。鲤上皮瘤细胞系(epithelioma papilloma cyprini,EPC)、虹鳟(Oncorhynchus mykiss)性腺细胞系(rainbow trout gonad,RTG-2)来源于武汉大学中国典型培养物保藏中心;锦鲤鳍条细胞系(koi-fin)[13]、草鱼(Ctenopharyngodon idella)肾脏组织细胞系(grass carp kidney,CIK)[14]、斑点鲖(Ictalurus punctatus)肾脏细胞系(channel catfish kidney,CCK)[15]、匙吻鲟(Polyodon spathula)鳍条组织细胞系(paddlefish-fin,PF-Fin)[16]均由本实验室建立与保存。M199培养基、胰酶为sigma公司产品;胎牛血清(FBS)为Gibco公司产品。
1.2 病毒培养与滴度测定参考文献[6]培养异育银鲫脑组织细胞系GiCB。取新长成汇合单层细胞8瓶(T25培养瓶,Corning,USA),6瓶为感染实验组,2瓶为感染对照组。吸弃培养基,感染实验组每瓶接种CyHV-2细胞培养病毒液1 mL,感染复数(multiplicity of infection,MOI)为0.1,并加入终浓度为10 μg/mL Polybrene,28 ℃孵育,每隔20 min轻微晃动培养瓶以便均匀吸附。吸附1 h后,吸弃病毒液,加入5 mL细胞维持液[含2%(V/V)血清的M199培养基]。感染对照组细胞添加1 mL无血清的M199培养基以模拟病毒感染,其他操作与病毒感染实验组一致。逐日于倒置显微镜下观察细胞状态,待细胞单层出现80%细胞病变效应(cytopathic effect,CPE)时收获细胞培养物并混合,-80 ℃至室温条件下冻融2次,于4 ℃条件下3000 r/min离心20 min,收集病毒上清液进行病毒滴度(TCID50/mL) 测定,并分装于冻存管中(Corning,USA),每管0.5 mL,-80 ℃保存备用。
病毒滴度测定采用微孔板培养法[11]。将胰酶消化分散后的GiCB细胞参照细胞正常传代培养方法接种于96孔板中(Corning,USA),每孔接种0.1 mL,每孔细胞数约1×104~2×104个。然后将上述分装保存的病毒液用不含血清的M199培养基(添加Polybrene,浓度为20 μg/mL)进行10倍稀释,将10倍系列稀释的病毒液按浓度梯度分别接种于96孔板中,每孔0.1 mL,每个稀释度接种6孔,同时设置正常细胞对照,28 ℃培养。逐日观察细胞病变情况,7 d后记录病变孔数;以Reed-Muench法计算病毒半数感染剂量(TCID50)[11]。
1.3 病毒理化特性测定热处理敏感性实验 取3管“1.2节”中制备的GiCB细胞培养病毒液,实验组分别置于56和65℃水浴中保温处理30 min;对照组置于20℃保温处理30 min,分别进行病毒滴度(TCID50/mL)的测定,设3次重复实验。
酸碱度敏感性实验 取3管“1.2节”中制备的GiCB细胞培养的病毒液,实验组分别用HCl(1 mol/L)和NaOH(1 mol/L)调整其pH值为3.0和10.0,于20 ℃处理60 min后,再调节pH值至7.0;对照用不含血清的M199培养基作相同的处理,分别进行病毒滴度(TCID50/mL)的测定,设3次重复实验。
氯仿敏感性实验 取2管“1.2节”中制备的GiCB细胞培养病毒液,实验组加入终浓度为4.8%(V/V) 的氯仿,4 ℃振荡孵育10 min后3000 r/min离心20 min,吸取上层水相;对照组用不含血清的M199培养基作相同的处理,分别进行病毒滴度(TCID50/mL)的测定,设3次重复实验。
乙醚敏感性实验 取2管“1.2节”中制备的GiCB细胞培养病毒液,实验组加入终浓度为20%(V/V)的乙醚,振荡10 min后置于4 ℃孵育24 h,期间摇动数次,然后3000 r/min离心20 min,吸取下层病毒液并反复吹打使残留乙醚挥发;对照组用不含血清的M199培养基作相同的处理,分别进行病毒滴度(TCID50/mL)的测定,设3次重复实验。
冻融稳定性实验 取6管“1.2节”中制备的GiCB细胞培养病毒液,于-80 ℃至室温下分别冻融1、2、3、4、5和6次,然后分别进行病毒滴度(TCID50/mL)的测定,设3次重复实验。
1.4 病毒的生物学特性测定病毒增殖曲线 取新长至汇合单层的GiCB细胞16瓶,2瓶作为未接毒对照组(T25培养瓶,Corning,USA),其他14瓶以MOI为0.1的接种量接种CyHV-2细胞培养病毒液,于接种后6、12、24、48、72、96和120 h分别随机取2瓶收集细胞培养病毒材料,冻融2次后4 ℃ 3000 r/min离心10 min去除细胞碎片,在GiCB细胞中进行TCID50/mL测定,设重复3次测定实验。
不同来源细胞对CyHV-2感染的敏感性 分别取新长至汇合单层的EPC、RTG-2、Koi-Fin、CIK、CCK和PF-Fin细胞各2瓶,每瓶细胞接种MOI为0.1的CyHV-2 细胞培养病毒液,逐日观察CPE,7 d后收获病毒,使用GiCB细胞进行TCID50/mL测定,设3次重复测定实验。将各组收获的病毒分别盲传7代,收获细胞培养物。用DNAzol试剂(Invitrogen)提取病毒核酸,以CyHV-2的DNA解旋酶基因序列设计PCR引物(表1),对各组细胞培养物进行巢式PCR检测[5, 12]。
| 表1 CyHV-2 Nested-PCR引物 Tab. 1 Primer sequences in CyHV-2 Nested-PCR assay |
取生长至汇合单层的GiCB细胞10瓶,以MOI为0.1的接种量接种CyHV-2细胞培养病毒液,于接种后12、24、48和96 h吸弃培养液,分别收集细胞,经2%(V/V)戊二醛固定2 h后将细胞刮下并离心10 min(4000 r/min)收集细胞沉淀。细胞沉淀经四氧化锇固定、梯度脱水、渗透、包埋后进行超薄切片,醋酸铀-枸橼酸铅双染色后,通过透射电子显微镜(Hitachi H-7650,Hitachi High-Technologies Corporation,Tokyo,Japan)观察CyHV-2在GiCB细胞内的超微形态发生过程。
2 结果 2.1 病毒培养滴度CyHV-2接种GiCB后48 h细胞开始病变,72 h后细胞病变效应(CPE)明显。与正常细胞(图1-a)对比,病变细胞收缩变圆,折光度增加,出现细胞聚集融合,细胞碎片增多,细胞单层崩解脱落形成破鱼网状(图1-b)。CyHV-2在GiCB细胞上可稳定增殖,病毒连续传代超过40代,细胞病变稳定,以Reed-Muench法计算病毒半数感染剂量为107.52±0.26 TCID50/mL。

|
图1
CyHV-2感染GiCB细胞72 h后的细胞病变效应 (a) 正常GiCB细胞;(b) CyHV-2感染GiCB细胞的细胞病变效应 Fig.1 Cytopathic effect of CyHV-2 infected GiCB cells at 72 h post- infection (a) normal GiCB cells; (b) cytopathic effect in GiCB cells after CyHV-2 infection |
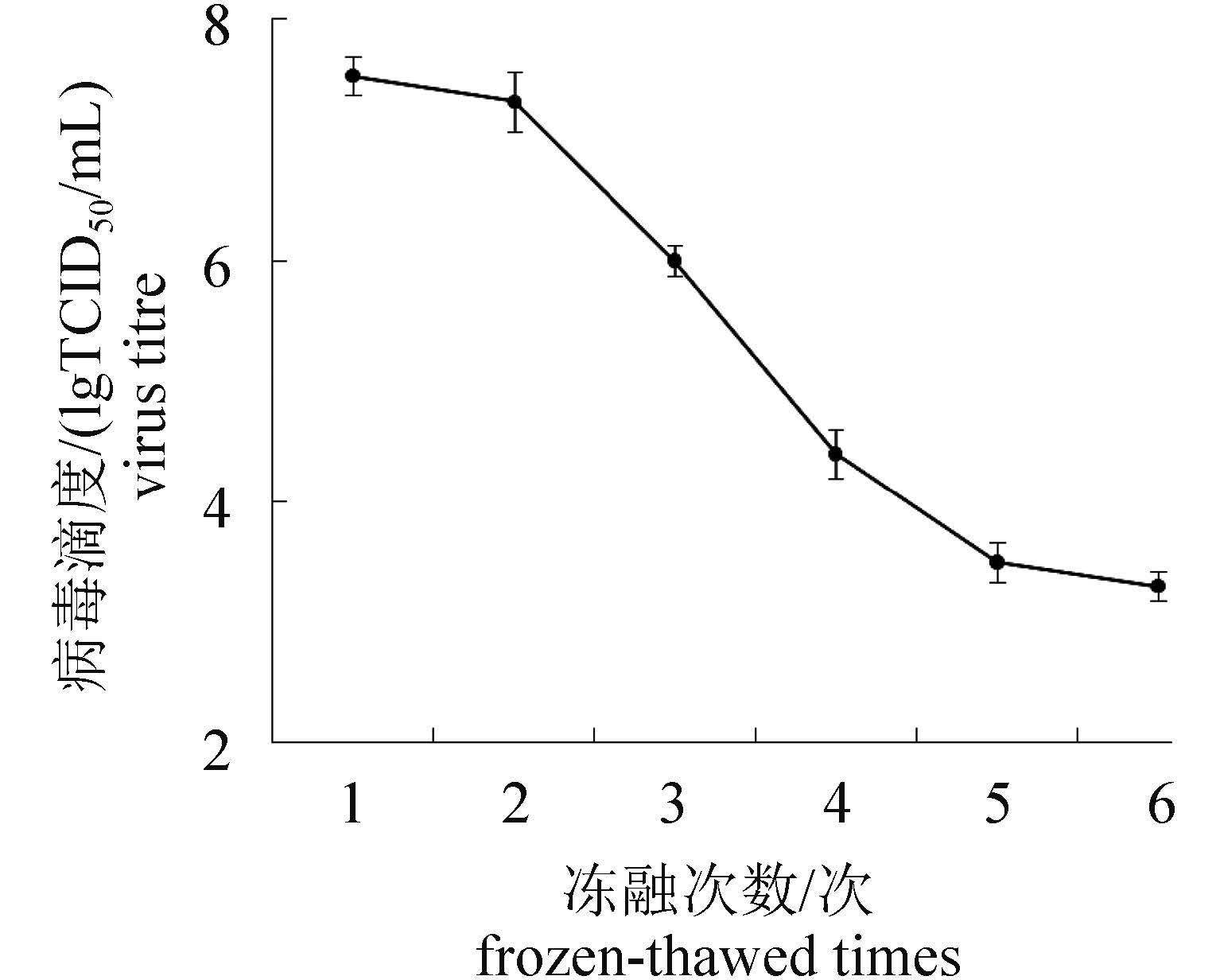
CyHV-2经热处理、酸处理、有机溶剂处理后均丧失感染活性,pH 10.0条件下处理病毒可使病毒滴度显著降低(P < 0.05,表2)。随着冻融次数的增多,病毒滴度不断下降,变化显著(P < 0.05,图2)。
| 表2 CyHV-2的理化特性 Tab. 2 Physical-chemical characteristic of the CyHV-2 |
|
图2 冻融次数对CyHV-2滴度的影响 Fig.2 Effect of frozen-thawed times on the titer of CyHV-2 |
病毒增殖曲线 CyHV-2在GiCB细胞中的增殖动态表明,病毒感染细胞经过12 h的隐晦期,24 h开始进入对数生长期,96 h病毒滴度达到高峰(107.52±0.26 TCID50/mL),然后进入平台期(图3)。

|
图3 CyHV-2感染GiCB细胞的增殖曲线 Fig.3 Growth curve of CyHV-2 in GiCB cells |
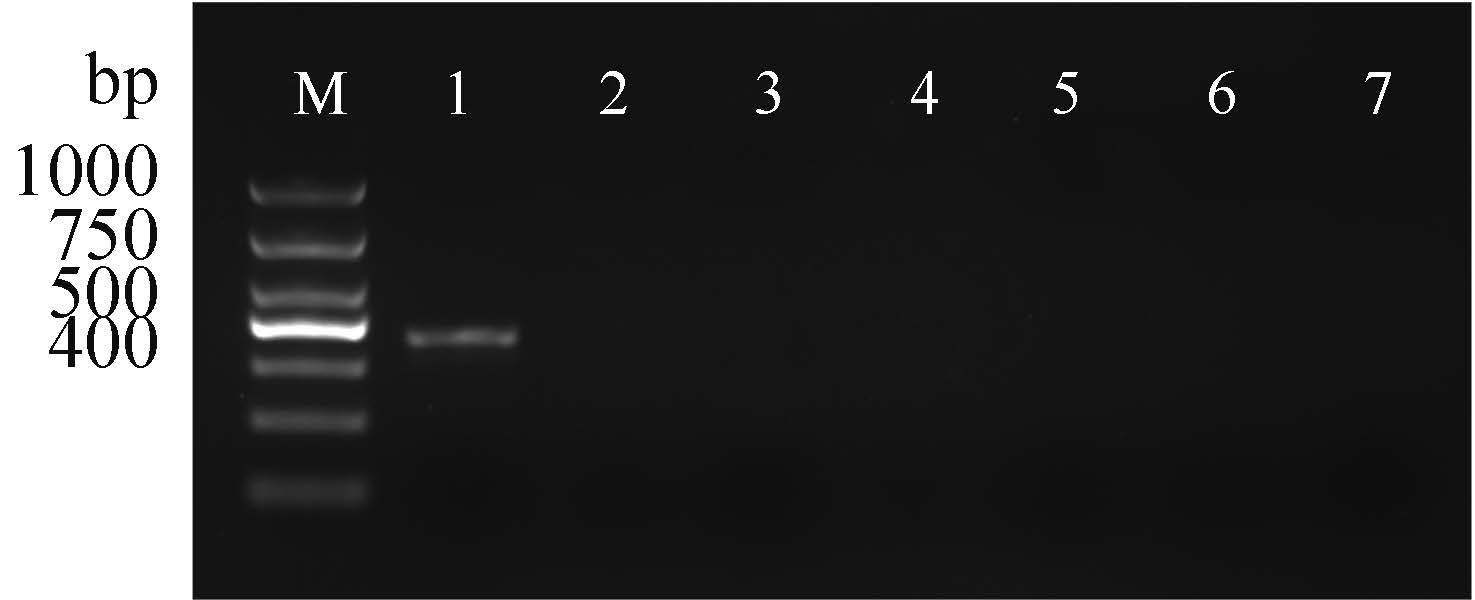
不同来源细胞对CyHV-2感染的敏感性 CyHV-2不能在EPC、RTG-2、CIK、CCK和PF-Fin细胞中增殖,病毒接种7 d均未出现CPE,且盲传培养7次亦均未观察到CPE;病毒接种Koi-Fin细胞,7 d出现轻微CPE,但病毒滴度较低(102.0±0.17TCID50/mL),与GiCB细胞培养的病毒滴度差异极显著(P < 0.01,表3)。病毒培养物在Koi-Fin细胞上连续传代培养5次后,未能再观察到CPE。以CyHV-2的DNA解旋酶基因序列设计的巢式PCR引物,对各组病毒培养物盲传或连续培养7次后的样本进行巢式PCR检测,结果显示仅GiCB培养组能扩增出357 bp的单一条带,其他细胞组病毒样本检测均为阴性(图4)。
| 表3 不同来源细胞系对CyHV-2感染的敏感性 Tab. 3 Susceptibility of different cell lines to the CyHV-2 |
|
图4
不同细胞培养组CyHV-2的巢式PCR检测 M. DL1000 DNA ladder;泳道1. GiCB细胞培养CyHV-2组;泳道2. Koi-Fin细胞培养CyHV-2组;泳道3. EPC细胞培养CyHV-2组;泳道4. RTG-2细胞培养CyHV-2组;泳道5. CIK细胞培养CyHV-2组;泳道6. CCK细胞培养CyHV-2组;泳道7. PF-Fin细胞培养CyHV-2组 Fig.4 Nested-PCR assay of cell culture-grown CyHV-2 in different cell lines M. DL1000 DNA ladder; lane 1. CyHV-2 grown in GiCB cells; lane 2. CyHV-2 grown in Koi-Fin cells; lane 3. CyHV-2 in grown EPC cells; lane 4. CyHV-2 grown in RTG-2 cells; lane 5. CyHV-2 grown in CIK cells; lane 6. CyHV-2 grown in CCK cells; lane 7. CyHV-2 grown in PF-Fin cells |
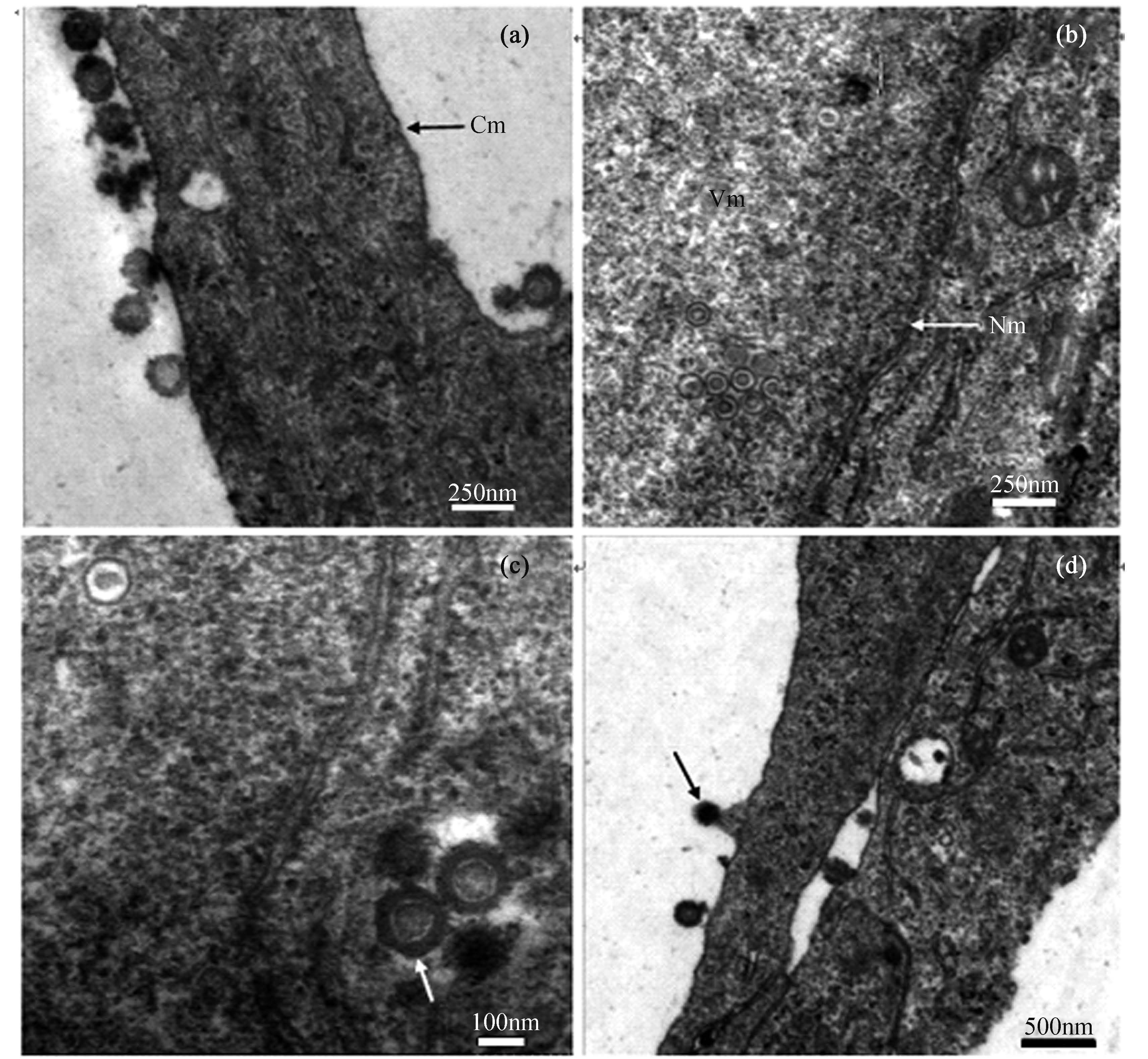
透射电子显微镜观察CyHV-2感染GiCB细胞后不同时期的超薄切片,结果表明,病毒感染细胞可分为吸附与侵入、复制与装配、成熟与释放3个主要阶段。感染初期病毒颗粒吸附于细胞表面,与细胞膜融合侵入细胞内(图5-a);病毒粒子进入细胞后,其基因组释放到宿主细胞核中进行大量的复制,核内出现明显的电子密度较低的区域为病毒合成区(viromatrix,VM),在病毒合成区存在大量已组装但没有皮质和囊膜的未成熟病毒粒子(图5-b);感染后期细胞内存在大量典型的疱疹病毒颗粒,成熟的CyHV-2颗粒为具囊膜的球形病毒,病毒核衣壳为正二十面体,呈六角形或球形,直径为110~120 nm,具囊膜的病毒颗粒直径为170~200 nm(图5-c);成熟的带有皮质及囊膜的病毒粒子聚集在细胞质中并以出芽的方式释放(图5-d)。
|
图5
CyHV-2感染的GiCB细胞的超薄切片电镜观察 (a) 病毒颗粒趋近并吸附于细胞表面,Cm. 细胞膜(cytomembrane)(×8000);(b) 病毒侵入细胞并在细胞核中大量复制和增殖,装配成病毒核衣壳,Vm. 病毒合成区(viromatrix),Nm. 细胞核核膜(nuclear membranes)(×6000);(c) 细胞质中成熟的带有皮质和囊膜的病毒粒子(箭头所示)(×15 000);(d) 成熟的病毒颗粒通过细胞膜以出芽的方式释放(箭头所示)(×6000) Fig.5 Electron microscopy observation of the CyHV-2 in infected GiCB cells (a) virions entered cells by fusion after adsorption to the cell membrane, Cm. cytomembrane (original magnification ×8000); (b) non-enveloped virus particles aggregated in the cytoplasm, Vm. viromatrix, Nm. nuclear membranes (original magnification ×6000); (c) enveloped mature virions in the cytoplasm (arrow) (original magnification ×15 000); (d) budding releases of mature virions from the plasma membrane (arrow) (original magnification ×6000) |
鲤疱疹病毒II型(CyHV-2)感染养殖鲫引起的鲫造血器官坏死症是我国新近暴发的高度传染性疾病,已经造成重大经济损失[5]。鲤疱疹病毒II型的宿主范围主要为金鱼、鲫及鲫杂交变种,而对建鲤 (C. carpio var. jian)、罗非鱼 (Oreochromis sp.)、草鱼、鲢 (Hypophthalmichthys molitrix)、乌鳢 (Channa argus)等无致病性[11, 18]。本实验室人工感染实验结果表明,异育银鲫从水花、乌子、寸片、大规格鱼种以及成鱼均对鲤疱疹病毒II型敏感,死亡率高达90%以上。鲤疱疹病毒II型感染性强、致死率高,但感染谱窄,非原始宿主细胞很难培养CyHV-2[1, 5, 6, 19],这严重制约了对CyHV-2理化及生物学特性、感染与致病机理以及防治技术的深入研究。本研究利用新建立的对CyHV-2敏感的鲫脑组织细胞系GiCB进行病毒培养及滴度测定,对CyHV-2的理化及生物学特性进行了详细的研究,比较了不同来源鱼类细胞系对CyHV-2的敏感性,并研究了CyHV-2在体外培养细胞中的增殖与形态发生过程。
研究发现,CyHV-2对酸碱和有机溶剂敏感,冻融可显著降低病毒感染活性,与该病毒具有皮质和囊膜有关。CyHV-2可在GiCB细胞中稳定增殖,病毒接种细胞后24 h开始进入对数生长期,96 h病毒滴度达到峰值(107.52±0.26 TCID50/mL),极显著高于CyHV-2在金鱼鳍条细胞(GFF)中的滴度(102.0 TCID50/mL)[19]。病毒的增殖曲线揭示了病毒在宿主细胞内的感染与增殖特征,为收获病毒材料的最佳时间点提供了参考依据,这对于收获高滴度病毒材料制备CyHV-2细胞培养灭活疫苗具有重要参考价值。
细胞培养分离病毒技术是最经典的诊断病毒病的方法,通常是世界动物卫生组织 (OIE) 推荐的鱼类病毒病诊断的首选方法。已有研究发现,CyHV-2很难在常用鱼类细胞系中增殖[1, 2, 3, 4, 5, 6, 19]。本研究比较了不同来源鱼类细胞对CyHV-2感染的敏感性,CyHV-2接种EPC、RTG-2、CIK、CCK和PF-Fin等鱼类细胞系后,7 d均未出现CPE,初步证实CyHV-2不能在鱼类细胞系EPC、RTG-2、CIK、CCK、PF-Fin细胞中增殖;通过对上述细胞培养的CyHV-2进一步的盲传培养以及特异性PCR检测,传代培养7次亦未观察到细胞病变效应,PCR检测结果亦为阴性。CyHV-2接种Koi-Fin细胞,7 d出现轻微CPE,但病毒滴度较低(102.0±0.17TCID50/mL),并且连续传代培养5次后,不再产生CPE,该结果与多位学者研究结论相同[1, 5, 6, 19]。对其第7代传代培养物进行特异性PCR检测,其结果亦为阴性。Jung等[1]使用胖头逄(Pimephales promelas)细胞(fathead minnow,FHM),罗非鱼卵巢细胞 (tilapia ovary,TO-2) 分离CyHV-2,超过4代病毒均不能增殖;Ito等[19]报道了利用金鱼鳍条细胞(GFF)培养CyHV-2的结果,但病毒滴度低 (102.0TCID50/mL),这一结果与Gilad等[20]的结果一致。因此,认为非宿主来源的鱼类细胞系不能支持CyHV-2的复制与增殖,而来源于金鱼的鳍条细胞系(GFF)与来源于锦鲤的鳍条细胞系(Koi-Fin)只能有限地支持CyHV-2的复制与增殖,但病毒不能持续传代培养。
了解病毒侵染宿主细胞及其复制的超微形态发生过程对研究病毒与宿主关系、研发抗病毒感染技术有重要的意义[21]。尽管CyHV-2及其感染所致的病毒病已日益受到研究者的关注,但尚未有关于CyHV-2病毒粒子超微形态发生的研究报道。本研究利用超微结构生物学技术,观察到CyHV-2感染GiCB细胞的过程可分为吸附与侵入、复制与装配、成熟与释放等3个主要阶段,这一结果与锦鲤疱疹病毒(koi herpesvirus,KHV)的超微形态发生过程相似[22]。CyHV-2感染GiCB细胞后,通常48 h可观察到细胞病变,72 h后出现明显的CPE。但通过透射电镜观察被感染细胞,12 h即可观察到病毒吸附,48 h可观察到病毒合成区内存在大量已组装成没有皮质和囊膜的未成熟病毒核衣壳,72 h后在细胞质中可观察到成熟病毒颗粒以及通过出芽方式释放成熟病毒颗粒的过程,这表明通过超微结构观察可先于细胞病变效应的出现检测到病毒的存在。
本研究利用CyHV-2敏感细胞系GiCB,测定了CyHV-2的理化及生物学特性,比较了不同来源鱼类细胞系对CyHV-2感染的敏感性,观察到体外培养细胞中的CyHV-2病毒粒子及其超微形态发生过程,为CyHV-2的致病机理研究及利用体外培养的病毒材料制备病毒疫苗奠定了前期基础,对鲫造血器官坏死症的防控技术具有重要的意义。
| [1] | Jung S J, Miyazaki T. Herpesviral haematopoietic necrosis of goldfish, Carassius auratus (L.)[J]. Journal of Fish Diseases, 1995, 18(3): 211-220. |
| [2] | Groff J M, LaPatra S E, Munn R J, et al. A viral epizootic in cultured populations of juvenile goldfish due to a putative herpesvirus etiology[J]. Journal of Veterinary Diagnostic Investigation, 1998, 10(4): 375-378. |
| [3] | Davison A J, Eberle R, Ehlers B, et al. The order Herpesvirales[J]. Archives of Virology, 2009, 154(1): 171-177. |
| [4] | Hanson L, Dishon A, Kotler M. Herpesviruses that infect fish[J]. Viruses, 2011, 3(11): 2160-2191. |
| [5] | Xu J, Zeng L B, Zhang H, et al. Cyprinid herpesvirus 2 infection emerged in cultured gibel carp, Carassius auratus gibelio in China[J]. Veterinary Microbiology, 2013, 166(1-2): 138-144. |
| [6] | Ma J, Jiang N, LaPatra S E, et al. Establishment of a novel and highly permissive cell line for the efficient replication of cyprinid herpesvirus 2 (CyHV-2)[J]. Veterinary Microbiology, 2015, 177(3-4): 315-325. |
| [7] | Doszpoly A, Benko M, Csaba G, et al. Introduction of the family Alloherpesviridae: the first molecular detection of herpesviruses of cyprinid fish in Hungary[J]. Magyar Allatorvosok Lapja, 2011, 133(3): 174-181. |
| [8] | Daněk T, Kalous T, Veselý T, et al. Massive mortality of Prussian carp Carassius gibelio in the upper Elbe basin associated with herpesviral hematopoietic necrosis (CyHV-2)[J]. Diseases of Aquatic Organisms, 2012, 102(2): 87-95. |
| [9] | Fichi G, Cardeti G, Cocumelli C, et al. Detection of Cyprinid herpesvirus 2 in association with an Aeromonas sobria infection of Carassius carassius (L.), in Italy[J]. Journal of Fish Disease, 2013, 36(10): 823-830. |
| [10] | Wang L, He J Q, Liang L Q, et al. Mass mortality caused by Cyprinid Herpesvirus 2 (CyHV-2) in Prussian carp (Carassius gibelio) in China[J]. Bulletin-European Association of Fish Pathologists, 2013, 32(5): 164-173. |
| [11] | 李莉娟, 罗杨志, 刘学芹, 等. 金鱼鲤疱疹病毒Ⅱ型的分子诊断[J]. 华中农业大学学报, 2013, 32(1): 92-96.Li L J, Luo Y Z, Liu X Q, et al. Molecular surveillance of Cyprinid herpesvirus 2 in goldfish cultured in China[J]. Journal of Huazhong Agricultural University, 2013, 32(1): 92-96 (in Chinese). |
| [12] | 徐进, 曾令兵, 杨德国, 等. 鲤疱疹病毒2型武汉株的分离与鉴定[J]. 中国水产科学, 2013, 20(6): 1303-1309.Xu J, Zeng L, Yang D, et al. Isolation and characterization of Cyprinid herpesvirus 2 WH strain[J]. Journal of Fishery Sciences of China, 2013, 20(6): 1303-1309 (in Chinese). |
| [13] | 肖艺, 曾令兵, 徐进, 等. 锦鲤鳍条组织细胞系的建立及其生物学特性[J]. 中国细胞生物学学报, 2012, 34(8): 767-774.Xiao Y, Zeng L B, Xu J, et al. Establishment and characterization of a cell line derived from fin of Cryprinus carpiod[J]. Chinese Journal of Cell Biology, 2012, 34(8): 767-774 (in Chinese). |
| [14] | 左文功, 钱华鑫, 许映芳, 等. 草鱼肾组织细胞系CIK的建立及其生物学特性[J]. 水产学报, 1986, 10(1): 11-17.Zuo W G, Qian H X, Xu Y F, et al. A cell line derived from the kidney of grass CARP (Ctenopharyngodon idellus)[J]. Journal of Fisheries of China, 1986, 10(1): 11-17 (in Chinese). |
| [15] | 曾令兵, 李晓莉, 张林, 等. 斑点叉尾鲖肾脏组织细胞系的建立及其生物学特性[J]. 中国水产科学, 2009, 16(1): 75-81.Zeng L B, Li X L, Zhang L, et al. Establishment and characterization of a cell line derived from kidney of channel catfish, Ictaluris punctatus[J]. Journal of Fishery Sciences of China, 2009, 16(1): 75-81 (in Chinese). |
| [16] | 肖艺, 曾令兵, 李晓莉, 等. 匙吻鲟鳍条组织细胞系的建立及其生物学特性[J]. 中国细胞生物学学报, 2010, 32(4): 533-540.Xiao Y, Zeng L B, Li X L, et al. Establishment and characterization of a cell line derived from fin of paddlefish, Polyodon spathula Walbaum[J]. Chinese Journal of Cell Biology, 2010, 32(4): 533-540 (in Chinese). |
| [17] | Reed L J, Muench H. A simple method of estimating fifty percent endpoints[J]. The American Journal of Hygiene, 1938, 27(3): 493-497. |
| [18] | 周勇, 曾令兵, 张辉, 等. 鲤疱疹病毒Ⅱ型TaqMan real-time PCR检测方法的建立及应用[J]. 水产学报, 2013, 37(4): 607-613.Zhou Y, Zeng L B, Zhang H, et al. Establishment of a TaqMan real-time PCR assay for detecting the Cyprinid herpesvirus Ⅱ[J]. Journal of fisheries of China, 2013, 37(4): 607-613 (in Chinese). |
| [19] | Ito T, Kurita J, Ozaki A, et al. Growth of cyprinid herpesvirus 2 (CyHV-2) in cell culture and experimental infection of goldfish Carassius auratus[J]. Diseases of Aquatic Organisms, 2013, 105(3): 193-202. |
| [20] | Gilad O, Yun S, Zagmutt V F J, et al. Concentrations of a Koi herpesvirus (KHV) in tissues of experimentally-infected Cyprinus carpio koi as assessed by real-time TaqMan PCR[J]. Diseases of Aquatic Organisms, 2004, 60(3): 179-187. |
| [21] | Ma J, Zeng L B, Zou Y, et al. Ultrastructural morphogenesis of an amphibian iridovirus isolated from Chinese giant salamander (Andrias davidianus)[J]. Journal of Comparative Pathology, 2014, 150(2-3): 325-331. |
| [22] | Miyazaki T, Kuzuya Y, Yasumoto S, et al. Histopa-thological and ultrastructural features of Koi herpesvirus (KHV)-infected carp Cyprinus carpio, and the morphology and morphogenesis of KHV[J]. Diseases of Aquatic Organisms, 2008, 80(1): 1-11. |
 2016, Vol. 40
2016, Vol. 40


